Возникновение - скачок - потенциал
Cтраница 3
Во всех случаях причиной возникновения скачка потенциала является окислительно-восстановительный процесс на поверхности электродов как металлических, так и неметаллических ( газовых, графитового и пр. Следовательно, электродный потенциал характеризует окислительно-восстановительные свойства системы. К сожалению, ни теоретически рассчитать, ни экспериментально определить абсолютную величину электродного потенциала не удается. Если ( задавшись целью определить потенциал металла по отношению к раствору его соли) присоединить электрод к вольтметру и опустить другой конец провода, дущего от прибора, в тот же раствор, то измерим не электродный потенциал металла, а разность потенциалов между металлом электрода и металлом провода. [31]
Известно, что в возникновении скачка потенциала на поверхности электрода может участвовать не только выход его ионов в раствор или осаждение их из раствора на электрод ( гл. [32]
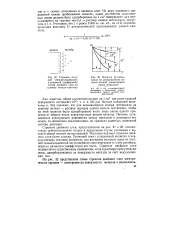 |
Строение плотной ( гельмгольцевской и размытой ( диффузной частей двойного слоя на границе металл-раствор.| Влияние ф - потен-циала на распределение падения ионной концентрации около электрода. [33] |
Это означает, что для возникновения скачка потенциала на границе металл - раствор порядка одного вольта достаточно, чтобы на этой границе было адсорбировано всего лишь около одного процента от общего числа поверхностных атомов металла. Поэтому установление электродного равновесия между металлом и раствором его ионов, за немногими исключениями, не приносит заметных изменений состава раствора. [34]
 |
Поверхностный скачок по.| Гальвани-потенциал g L L на. [35] |
Одной из наиболее общих причин возникновения скачка потенциала между фазами является обмен заряженными частицами. [36]
Второй принцип правильно отражает механизм возникновения равновесного скачка потенциала на границе металл - раствор, хотя обмен ионами не исчерпывает всех возможных причин, ответственных за образование скачка потенциала на этой границе. Если между электродом и раствором существует равновесие, то величина электродного потенциала будет мерой изменения свободной энергии F ( или термодинамического потенциала G), которая отвечает электродной реакции. При заданной электродной реакции электродный потенциал должен быть определенной и постоянной величиной. [37]
Второй принцип правильно отражает механизм возникновения равновесного скачка потенциала на границе металл - раствор, хотя обмен ионами не исчерпывает всех возможных причин, ответственных за образование скачка потенциала на этой границе. Если между электродом и раствором существует равновесие, то величина электродного потенциала будет мерой изменения свободной энергии зр ( или термодинамического потенциала G), соответствующей электродной реакции. При заданной электродной реакции электродный потенциал должен быть определенной и постоянной величиной. [38]
 |
Соотношение между энергией выхода катионов t / м и энергией. [39] |
Существует несколько теорий, объясняющих механизм возникновения скачка потенциала на границе раствор - металл. [40]
Наличие двойного электрического слоя приводит к возникновению скачка потенциала. [41]
На этой основе им была создана качественная картина возникновения скачка потенциала на границе металл-раствор и количественная зависимость величины скачка этого потенциала для металлических электродов первого рода от концентрации раствора. Из теории Нернста, в частности, следовал вывод о независимости стандартных ( нормальных) потенциалов электродов от природы растворителя, поскольку величина электролитической упругости растворения Р, определяющая нормальный ( или стандартный) потенциал металла, не являлась функцией свойств растворителя, а зависела только от свойств металла. [42]
С помощью указанных принципов Нернст получил качественную картину возникновения скачка потенциала металл - раствор и вывел количественную зависимость величины этого скачка от состава раствора. [43]
 |
Работа выхода электрона для ряда металлов. [44] |
Второй принцип находится в согласии с вероятным механизмом возникновения равновесного скачка потенциала на границе металл - раствор, хотя обмен ионами не исчерпывает всех возможных причин, приводящих к образованию скачка потенциала на этой границе. Если между электродом и раствором существует равновесие, то электродный потенциал будет мерой изменения изобарно-изотермического потенциала О соответствующей электродной реакции. При заданной электродной реакции электродный пэтенциал должен быть определенной и постоянной величиной. [45]
Страницы: 1 2 3 4