Возрастание - концентрация - электролит
Cтраница 2
Однако при практическом определении осмотического давления эта полная диссоциация обнаруживается лишь при низких концентрациях взятого электролита. С возрастанием концентрации электролита осмотическое давление тановится ниже, чем это соответствует полной диссоциации вещества. По мере роста концентрации расхождение увеличивается. [16]
В изоэлектрической точке, отвечающей для амфотерных по своим свойствам поверхностей тому состоянию, когда число ионов разных знаков в пограничном слое одинаково и двойной слой исчезает, отсутствует и механизм для осуществления направленного потока жидкости. При возрастании концентрации электролита в растворе диффузный слой ионов сжимается и принимает структуру гельмгольцевского слоя, что также приводит к исчезновению механизма для передвижения жидкости, и электроосмос прекращается. [17]
Явление неправильных рядов объясняется следующим. По мере возрастания концентрации электролита достигается порог коагуляции, наступает первая зона коагуляции. Частицы дисперсной фазы теряют заряд и поэтому не передвигаются в электрофоре-тической трубке. Будучи трехвалентными, эти ионы обладают большой адсорбируемостью; их адсорбция идет с такой скоростью, что нейтральные частицы золя успевают приобрести достаточный заряд прежде, чем наступит коагуляция. Катионы Fe, являющиеся в данном случае потенциалопределяю-щими ионами, сообщают частицам положительный заряд, о чем говорит их передвижение к катоду. [18]
При более низкой концентрации имеется свободный растворитель и эту систему можно рассматривать как растворы соли в воде. Выше этого предела свободного растворителя нет; при возрастании концентрации электролита происходит только перераспределение воды в сольватных сферах в пользу более гидрофильного иона и система является как бы раствором воды в раздвинутой решетке электролита. Реальность этой границы была под-тиерждена рядом независимых методов. [19]
При более низкой концентрации имеется свободный растворитель и эту систему можно рассматривать как растворы соли в воде. Выше этого предела свободного растворителя нет; при возрастании концентрации электролита происходит только перераспределение воды в сольватных сферах в пользу более гидрофильного иона и система является как бы раствором воды в раздвинутой решетке электролита. Реальность этой границы была подтверждена рядом независимых методов. [20]
Первая же капля N32804 после точки эквивалентности вызовет резкое увеличение электрической проводимости благодаря возрастанию концентрации электролита в растворе. [21]
Этот электрокинетический ток прямо пропорционален величине - потенциала и зависит от концентрации таким образом, что при возрастании концентрации электролита в растворе диффузный слой сжимается и - потенциал стремится к нулю, сводя к нулю и величину потенциала седиментации. [22]
Электрокинетический то к будет отвечать переносу электрических зарядов в единицу времени вследствие относительного смещения подвижной части двойного слоя при движении частиц как целого со слоем жидкости в пристенном слое. Этот электрокинетический ток прямо пропорционален величине - потенциала и зависит от концентрации таким образом, что при возрастании концентрации электролита в растворе диффузный слой сжимается и - потенциал стремится к нулю, сводя к нулю и величину потенциала седиментации. [23]
Если мы теперь рассмотригл зависимость величины электрокинетического потенциала от концентрации электролита в растворе, то увидим, что увеличение концентрации раствора, как это было отмечено ранее, приводит к уменьшению толщины двойного слоя. Ввиду того, что положение плоскости АВ, ограничивающей неподвижный пристенный слой с первым слоем противоионов, предполагается при этом неизменным, то с возрастанием концентрации электролита количество зарядов в подвижной части двойного слоя, как показывает пунктирная кривая р, уменьшается. Дэ, уменьшается и величина электрокинетического потенциала. [24]
Если мы теперь рассмотрим зависимость величины электрокинетического потенциала от концентрации электролита в растворе, то увидим, что увеличение концентрации раствора, как это было отмечено ранее, приводит к уменьшению толщины двойного слоя. Ввиду того, что положение плоскости АВ, ограничивающей неподвижный пристенный слой с первым слоем противоионов, предполагается при этом неизменным, то с возрастанием концентрации электролита количество зарядов в подвижной части двойного слоя, как показывает пунктирная кривая р, уменьшается. Вместе с уменьшением эффективного заряда, который как функция от положения границы смещения фаз АВ показан на рис. 17 отдельно в виде пунктирной штриховой линии Дэ, уменьшается и величина электрокинетического потенциала. При достаточно высокой концентрации электролита толщина ионной атмосферы может быть настолько понижена, что величины эффективного заряда Д и - потенциала сделаются равными нулю, и электрокинетические эффекты исчезают. Влияние толщины диффуз-ние знака электрокинетическо-ного слоя на g - потенциал. [25]
Данные о зависимости ионообменных равновесий на цеолите А от природы аниона и от присутствия комплексообразователен весьма ограниченны. Авторы работы [18] исследовали обмен ионов кальция, кадмия и цинка в растворах различных электролитов ж разработали метод определения констант ионообменного равновесия для комплексных анионов, который, кроме того, позволяет рассчитать число лигандов в образующихся комплексных соединениях. Установлено, что коэффициент селективности уменьшается с возрастанием концентрации электролита. Резкое снижение селективности объясняется тем, что, взаимодействуя с обмениваемым катионом ( например, кадмием), электролит образует анионный комплекс. Селективность снижается также из-за участия в обмене катиона электролита. В качестве метода декатиони-рования использовалась реакция образуется нерастворимой соли, в частности соли серебра. [26]
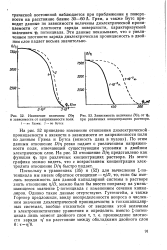 |
Изменение величины.| Зависимость величины D / r от гр, при различных концентрациях раствора. [27] |
По этим данным отношение D / ц резко падает с увеличением напряженности поля, отвечающей существующим условиям в двойном электрическом слое. На рис. 53 отношение D / r представлено как функция ipi при различных концентрациях раствора. Из этого графика можно видеть, что с возрастанием концентрации электролита отношение D / r быстро падает. [28]
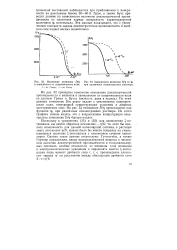 |
Изменение величины D / r [ IMAGE ] Зависимость величины D / ц от ifi в зависимости от напряженности поля. при различных концентрациях раствора. [29] |
По этим данным отношение D / ц резко падает с увеличением напряженности поля, отвечающей существующим условиям в двойном электрическом слое. На рис. 53 отношение D / ц представлено как функция i) i при различных концентрациях раствора. Из этого графика можно видеть, что с возрастанием концентрации электролита отношение D / r быстро падает. [30]
Страницы: 1 2 3