Возрастание - атомная масса
Cтраница 3
Металлические свойства рассматриваемых элементов выражены слабее, чем у соответствующих элементов главных подгрупп второй и особенно первой группы, а у бора преобладают неметалли -, ческие свойства. Однако с возрастанием атомной массы появляются и более низкие степени окисленности. [31]
Металлические свойства рассматриваемых элементов выражены слабее, чем у соответствующих элементов главных подгрупп второй и особенно первой группы, а у бора преобладают неметаллические свойства. Однако с возрастанием атомной массы появляются и более низкие степени окисленности. [32]
Первое построено в порядке возрастания атомной массы элементов, второе - в порядке группирования элементов по их химическому сходству. [33]
В соответствие этому закону и составлена периодическая система элементов, которая объективно отражает периодический закон. Весь ряд элементов, расположенных в порядке возрастания атомных масс, Д. И. Менделеев разбивает на периоды. [34]
На втором этапе обнаружение явления периодической повторяемости свойств элементов, изменения их от металлов к неметаллам и инертным элементам также требует объяснения причин и ставит учащихся в условия проблемной ситуации. Подчиненный характер носит проблема анализа причин нарушения последовательности возрастания атомных масс в случае аргон - калий. [35]
 |
Зависимость [ IMAGE ] Зависимость Д5 д, [ IMAGE ] Зависимость х от. [36] |
S P-P) при различных концентрациях электролита убывают с возрастанием атомной массы газа. [37]
Галогены обладают меньшим атомным весом, чем щелочные металлы, а эти последние меньшим, чем щелочноземельные. Значит, в непрерывном ряду элементов, расположенных в порядке возрастания атомной массы, вслед за фтором должны стоять натрий и магний, за хлором - калий и кальций, за бромом - рубидий и стронций, за иодом - цезий и барий. [38]
Так, сульфаты меди и никеля более токсичны для растений, чем нитраты и хлориды, для кобальта различий не обнаружено. Тяжелые металлы являются протоплазматическими ядами, токсичность которых увеличивается с возрастанием атомной массы. [39]
Это объясняет также существование большого числа соединений металлических элементов. В случае присутствия четырех или пяти электронов на внешних s - и р-уровнях метал лический характер структуры усиливается с возрастанием атомной массы ( переход от Sn и РЬ сопровождается появлением кубической гранецентрированной решетки. [40]
Важно отметить, что периодический закон был открыт Менделеевым еще задолго до того, как было установлено, что атомы состоят из ядер и электронов. Менделеев положил в основу формулировки периодического закона атомную массу ( по терминологии того времени - атомный вес), но тем не менее в некоторых случаях расположил элементы не в порядке возрастания атомных масс, а в том порядке, который диктовался всей совокупностью их свойств. В настоящее время периодический закон формулируется так: свойства элементов, а также образуемых ими простых и сложных веществ являются периодической функцией от зарядов их ядер. [41]
В главе VI Химические свойства окислов приводятся данные по характеру взаимодействия окислов с минеральными и органическими кислотами, смесями кислот, растворами щелочей, растворами и расплавами солей и газовыми средами, а также каталитические свойства окислов. В большинстве случаев приводятся температуры взаимодействия, характер продуктов взаимодействия. Окислы расположены в порядке возрастания атомных масс составляющих их элементов, для одного элемента - по возрастающему содержанию кислорода. [42]
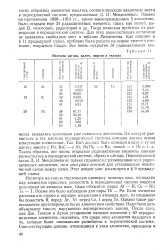 |
Изотопы аргона, калия, никеля и теллура. [43] |
Несмотря на самую тщательную проверку атомных масс, несколько пар элементов пришлось разместить в периодической системе вопреки величинам их атомных масс. Сюда относятся пары: Аг - К; Со - Ni; Те - I. Позже это было наблюдено для пары Th - Ра. Если элементы располагать строго в порядке возрастания атомных масс, то следовало бы поместить К перед Аг, Ni перед Со, I перед Те. [44]
Все это дало возможность Д. И. Менделееву открытый им закон назвать законом периодичности и сформулировать следующим образом: свойства простых тел, а также формы и свойства соединений элементов, находятся в периодической зависимости ( или, выражаясь алгебраически, образуют периодическую функцию) от величины атомных весов элементов. В соответствие этому закону составлена периодическая система элементов, которая объективно отражает периодический закон. Весь ряд элементов, расположенных в порядке возрастания атомных масс, Д. И. Менделеев разбивает на периоды. [45]
Страницы: 1 2 3 4