Возрастание - энергия - ионизация
Cтраница 1
Возрастание энергии ионизации при переходе от s - элементов I группы к р-элементам VIII группы обусловливается возрастанием эффективного заряда ядра. [1]
В каждом периоде периодической таблицы наблюдается общая тенденция к возрастанию энергии ионизации с увеличением порядкового номера элемента. Сродство к электрону оказывается наибольшим у кислорода и галогенов. [2]
Из данных табл. 5 видно, что общая тенденция к возрастанию энергии ионизации в пределах периода в некоторых случаях нарушается. [3]
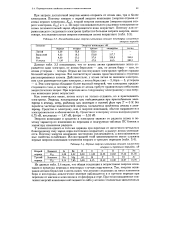 |
Последовательные энергии ионизации атомов некоторых элементов.| Первые энергии ионизации атомов элементов второго и третьего периодов, эВ. [4] |
Из данных табл. 3.4 видно, что общая тенденция к возрастанию энергии ионизации в пределах периода в некоторых случаях нарушается. Так, энергии ионизации атомов бериллия и азота выше, чем атомов следующих за ними элементов бора и кислорода; аналогичное явление наблюдается и в третьем периоде при переходе от магния к алюминию и от фосфора к сере. [5]
Из данных табл. 5 видно, что общая тенденция к возрастанию энергии ионизации в пределах периода в некоторых случаях нарушается. [6]
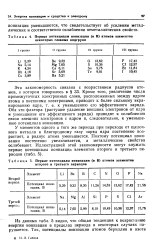 |
Первые потенциалы ионизации ( в В атомов элементов некоторых главных подгрупп.| Первые потенциалы ионизации ( в В атомов элементов второго и третьего периодов. [7] |
Из данных табл. 5 видно, что общая тенденция к возрастанию энергии ионизации в пределах периода в некоторых случаях нарушается. [8]
Во II периоде при переходе от лития ( 2s1) к неону ( 2s22p6) и в III периоде при переходе от натрия ( 3s1) к аргону ( 3s23p6) имеет место возрастание энергии ионизации. Вместе с тем это возрастание неравномерное, а именно у бора ( 2s22p), следующего за бериллием ( 2s2), и кислорода ( 2s22p4), следующего за азотом ( 2s22p3), равно, как и у их аналогов ( элементов III периода), энергии ионизации ниже ожидаемых. Наблюдаемый эффект связан с ослаблением эффекта экранирования заряда ядра атомов элементов, следующих непосредственно за атомами элементов с заполненной ns2 и наполовину заполненной пр3 валентными орби-талями. В целом наименьшие значения энергии ионизации имеют атомы элементов I группы, наибольшие - атомы благородных газов. [9]
Наименьшей энергией ионизации обладают s - элементы I группы, наибольшей - s - и р-элементы VIII группы. Возрастание энергии ионизации при переходе от - элементов I группы к р-элемен-там VIII группы обусловливается возрастанием заряда ядра. [10]
Рассмотрим теперь изменение энергий ионизации во втором периоде. Таким образом, при переходе от Li к Ne происходит возрастание энергии ионизации. Эта закономерность вытекает из особенностей электронного строения. У бериллия, имеющего конфигурацию Is22s2, внешняя s - оболочка заполнена, поэтому у следующего за ним бора электрон поступает в р-оболочку; р-электрон менее прочно связан с ядром, чем s - электрон, поэтому первая энергия ионизации у бора меньше, чем у бериллия. [11]
Рассмотрим теперь изменение энергий ионизации во втором периоде. Таким образом, при переходе от Li к Ne происходит возрастание энергии ионизации. Эта закономерность вытекает из особенностей электронного строения. У бериллия, имеющего конфигурацию Is22s2, внешняя s - оболочка заполнена, поэтому у следующего за ним бора, электрон поступает в / о-оболочку; / р-элект-рон менее прочно связан с ядром, чем s - электрон, поэтому первая энергия ионизации у бора меньше, чем у бериллия. [12]
Данные табл. 5 позволяют связать более тонкие изменения энергии ионизации с характером заполнения электронных оболочек. Для элементов второго периода при переходе от лития к неону наблюдается возрастание энергии ионизации. Это объясняется увеличением заряда ядра при постоянстве числа электронных слоев. В то же время возрастание энергий ионизации первого порядка происходит внутри периода немонотонно. Так, например, у бора и кислорода наблюдается заметное уменьшение Д по сравнению с предыдущими элементами - бериллием и азотом. Аналогичное нарушение монотонности в изменении числовых значений первых ионизационных потенциалов характерно и для других периодов системы. [13]
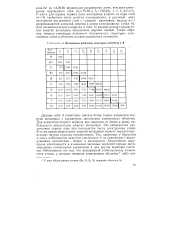 |
Потенциалы ионизации некоторых элементов в В. [14] |
Данные табл. 6 позволяют связать более тонкие изменения энергий ионизации с характером заполнения электронных оболочек. Для элементов второго периода при переходе от лития к неону наблюдается возрастание энергии ионизации. Это объясняется увеличением заряда ядра при постоянстве числа электронных слоев. В то же время возрастание энергий ионизации первого порядка происходит внутри периода неравномерно. Так, например, у бериллия и азота наблюдается заметное увеличение 1 по сравнению с последующими элементами - бором и кислородом. Аналогичное нарушение монотонности в изменении числовых значений первых ионизационных потенциалов характерно и для других периодов Системы. [15]
Страницы: 1 2