Возрастание - энергия - ионизация
Cтраница 2
Данные табл. 5 позволяют связать более тонкие изменения энергии ионизации с характером заполнения электронных оболочек. Для элементов второго периода при переходе от лития к неону наблюдается возрастание энергии ионизации. Это объясняется увеличением заряда ядра при постоянстве числа электронных слоев. В то же время возрастание энергий ионизации первого порядка происходит внутри периода немонотонно. Так, например, у бора и кислорода наблюдается заметное уменьшение 1 по сравнению с предыдущими элементами - бериллием и азотом. Аналогичное нарушение монотонности в изменении числовых значений первых ионизационных потенциалов характерно и для других периодов системы. [16]
На рис. 7 показан характер изменения энергии отрыва первого электрона от атома в зависимости от порядкового номера элемента. Кривая имеет ясно выраженный периодический характер. Наименьшей энергией ионизации ( 3 - 5 эв) обладают s - элементы I группы, наибольшей - s - и р-элементы VIII группы. Возрастание энергии ионизации при переходе от s - элементов I группы к р-элементам VIII группы обусловливается возрастанием эффективного заряда ядра. На возрастающих участках кривой значений энергии ионизации наблюдаются небольшие максимумы, отражающие явление вторичной периодичности. [17]
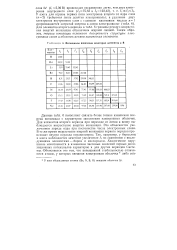 |
Потенциалы ионизации некоторых элементов в В. [18] |
Данные табл. 6 позволяют связать более тонкие изменения энергий ионизации с характером заполнения электронных оболочек. Для элементов второго периода при переходе от лития к неону наблюдается возрастание энергии ионизации. Это объясняется увеличением заряда ядра при постоянстве числа электронных слоев. В то же время возрастание энергий ионизации первого порядка происходит внутри периода неравномерно. Так, например, у бериллия и азота наблюдается заметное увеличение 1 по сравнению с последующими элементами - бором и кислородом. Аналогичное нарушение монотонности в изменении числовых значений первых ионизационных потенциалов характерно и для других периодов Системы. [19]
Данные табл. 5 позволяют связать более тонкие изменения энергии ионизации с характером заполнения электронных оболочек. Для элементов второго периода при переходе от лития к неону наблюдается возрастание энергии ионизации. Это объясняется увеличением заряда ядра при постоянстве числа электронных слоев. В то же время возрастание энергий ионизации первого порядка происходит внутри периода немонотонно. Так, например, у бора и кислорода наблюдается заметное уменьшение 1 по сравнению с предыдущими элементами - бериллием и азотом. Аналогичное нарушение монотонности в изменении числовых значений первых ионизационных потенциалов характерно и для других периодов системы. [20]
Данные табл. 5 позволяют связать более тонкие изменения энергии ионизации с характером заполнения электронных оболочек. Для элементов второго периода при переходе от лития к неону наблюдается возрастание энергии ионизации. Это объясняется увеличением заряда ядра при постоянстве числа электронных слоев. В то же время возрастание энергий ионизации первого порядка происходит внутри периода немонотонно. Так, например, у бора и кислорода наблюдается заметное уменьшение Д по сравнению с предыдущими элементами - бериллием и азотом. Аналогичное нарушение монотонности в изменении числовых значений первых ионизационных потенциалов характерно и для других периодов системы. [21]
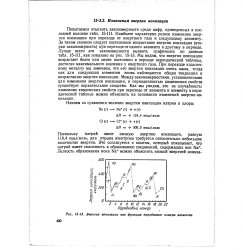 |
Энергия ионизации как функция порядкового номера элемента. [22] |
За таким скачком следует постепенное возрастание энергии ионизации ( вторая закономерность) при переходе от одного элемента к другому в периоде. Мы видим, что энергия ионизации возрастает более или менее постоянно в периоде периодической таблицы, достигая максимального значения у инертного газа. При переходе к щелочному металлу мы замечаем, что его энергия ионизации очень мала, тогда как для следующих элементов вновь наблюдается общая тенденция к возрастанию энергии ионизации. Между закономерностями, установленными для изменения энергии ионизации, и периодичностью химических свойств существует поразительное сходство. Как мы увидим, это не случайность: изменение химических свойств при переходе от элемента к элементу в периодической таблице можно объяснить на основании изменений энергии ионизации. [23]
Страницы: 1 2