Возрастание - энтропия - система
Cтраница 2
 |
Схема замкнутой адиабатической системы, внутри которой находятся тела А и В с температурами Тг и Т3. [16] |
Полученное неравенство ( 5 33) доказывает возрастание энтропии системы в случае необратимого адиабатического процесса. [17]
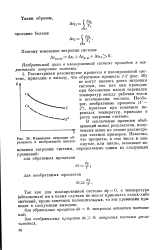 |
Изменение энтропии обратимого и необратимого циклов. [18] |
Необратимый цикл в изолированной системе приводит к возрастанию энтропии системы. [19]
Современная теория объясняет хелатный эффект прежде всего возрастанием энтропии системы ион металла - поли-дентатный лиганд при комплексообразовании. Строго говоря, в реакцию комплексообразования ионы металлов вступают в гидратированном состоянии. Реакция комплексообразования в сущности является процессом вытеснения координированных молекул воды лигандом. [20]
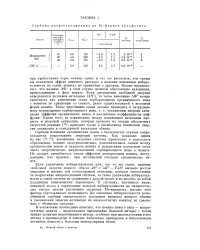 |
Сорбция хлортетрациклина на Na-формах сульфосмол. [21] |
Сорбция ионитами органических ионов в большинстве случаев сопровождается возрастанием энтропии системы. Как показано одним из нас [14 16], увеличение энтропии системы происходит в результате образования, помимо электровалентных, дополнительных связей между органическим ионом и каркасом ионита и возрастания вследствие этого числа энергетических микросостояний сорбированного иона в ионите. Не следует пренебрегать также эффектом дегидратации ионита, наступающим, как правило, при поглощении смолами органических ионов. [22]
Растворение с нулевым или отрицательным тепловым эффектом может быть объяснено только возрастанием энтропии системы, увН личением ее вероятности при смешении компонентов раствора ц взаимной диффузией их. [23]
Наиболее существенной идеей в термодинамике стационарных необратимых процессов является введение понятия скорости возрастания энтропии системы. [24]
Тепловой поток энтропии полезен также в том случае, когда требуется вычислить часть полного возрастания энтропии системы, обусловленную теплопереносом через различные участки граничной поверхности, находящиеся при разных значениях термодинамической температуры. [25]
Теплота растворения аморфных неполярных полимеров обычно имеет отрицательное значение, и растворение происходит вследствие возрастания энтропии системы. [26]
Иногда вытекающее из основного уравнения (2.99) уменьшение полезной внешней работы адиабатически изолированной системы с возрастанием энтропии системы из-за необратимости происходящих в ней реальных процессов связывают с якобы действующей в природе тенденцией всех процессов приводить к обесцениванию или деградации энергии. Согласно этой точке зрения, во Вселенной, которая рассматривается как изолированная система, с течением времени энтропия возрастает и вследствие этого уменьшается возможность превращения теплоты в работу, или, другими словами, происходит деградация энергии. В результате этого Вселенная в конце концов должна достигнуть состояния абсолютного теплового равновесия ( тепловой смерти по Клаузиусу иТомсону), при котором всякие процессы в ней прекратятся, а превращения энергии станут невозможными. [27]
Для некоторых простых необратимых процессов легко показать, что в изолированных системах течение их сопровождается возрастанием энтропии системы. Покажем, например, что переход теплоты от горячего тела к холодному сопровождается возрастанием энтропии. [28]
Вытекающее из уравнения ( 3 - 21) уменьшение полезной работы адиабатически изолированной системы с возрастанием энтропии системы из-за необратимости происходящих в ней реальных процессов иногда связывают с якобы действующей в природе тенденцией сех процессов приводить к обесцениванию или деградации энергии. Согласно этой точке зрения во Вселенной, которая рассматривается как изолированная система, с течением времени энтропия возрастает и вследствие этого уменьшается возможность превращения теплоты в работу или, другими славами, происходит деградация энергии. В результате этого Вселенная в конце концов должна достигнуть состояния абсолютного теплового равновесия ( ( тепловой смерти), при котором всякие процессы. [29]
Вспомним теперь, что, как было показано в предыдущем параграфе, необратимые процессы сопровождаются возрастанием энтропии системы. [30]
Страницы: 1 2 3 4