Суммарная адсорбция
Cтраница 1
Изотермы суммарной адсорбции органических веществ из биологически очищенных сточных вод Киева, Харькова, Первомайска ( Харьковской обл. [1]
У - изотерма суммарной адсорбции; 6 ( р, U) - изотерма локальной адсорбции; Д - интервал, в котором заключена энергия адсорбции. Первые математические методы определения функции F ( U) из экспериментальных изотерм адсорбции были предложены Тодесом, а также Сипсом и Рогинским. Чаще всего применяют метод, предложенный в работах Тодеса ж Сипса. В этом методе предполагается, что локальная изотерма 6 ( р, U) является ленгмюров-ской. [2]
Во всех случаях неоднородной поверхности суммарная адсорбция не подчиняется уравнению Лангмюра, а выражается, в зависимости от характера неоднородности, логарифмической изотер -, мой, уравнением Фрейндлиха или другими уравнениями. [3]
Во всех случаях неоднородной поверхности суммарная адсорбция не подчиняется уравнению Лангмюра, а выражается, в зависимости от характера неоднородности, логарифмической изотермой, уравнением Фрейндлиха или другими уравнениями. [4]
Связь между параметрами, характеризующими суммарную адсорбцию Многокомпонентной смеси, и индивидуальными адсорбционными характеристиками компонентов проанализирована в работе [170], Задачи такого рода часто приходитсй решать в практике проектирования адсорбционных установок Для очистки сточных вод предприятий, включающих комплекс разнородных производств. [5]
Рассмотрены современные методы решения интегрального уравнения, связывающего изотерму суммарной адсорбции с изотермой локальной адсорбции и функцией распределения энергии адсорбции. Описаны подходы к решению вопроса о стандартном методе вычисления функции распределения из экспериментальной изотермы. [6]
В табл. 1 и 2 приведено сопоставление расчетных и экспериментальных значений суммарной адсорбции смеси н-парафинов Cg - Cgj с н-гексаном и водяным паром. [7]
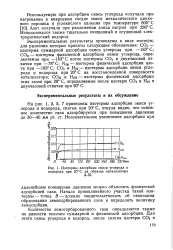 |
Изотермы адсорбции окиси углерода и. [8] |
Экспериментальные результаты приведены в виде изотерм, для различия которых приняты следующие обозначения: СОс - изотерма суммарной адсорбции окиси углерода при - 183 С; СОф - изотерма физической адсорбции окиси углерода, определяемая при - 183 С после изотермы СОс и двухчасовой откачки при - 78 С; N2 ( i) - изотерма физической адсорбции азота при - 183 С; COi и H2i - изотермы адсорбции окиси углерода и водорода при 20 С на восстановленной поверхности катализатора; СОц и Нгп - изотермы физической адсорбции этих газов при 20 С, определяемые после изотерм COi и H2i и двухчасовой откачки при 20 С. [9]
Из хода г, т-кривых рис. 1 следует, что заполнение поверхности прочно хемосорбированным, не окисляющимся при данном потенциале веществом происходит со скоростью, значительно меньшей, чем скорость суммарной адсорбции. Поэтому заполнение активным веществом, согласно уравнению ( 7), должно уменьшаться во времени до достижения стационарного состояния. Так как ток является симбатной функцией от активного заполнения, то г, т-кривая также должна иметь падающий участок при тех потенциалах, при которых на поверхности существует прочно хемосорбированное вещество. При ф 0 8 е, где 0Ф s 0, падающий участок на i, т-кривой, в соответствии с приведенными выше рассуждениями, отсутствует. Исходя из развитых выше представлений, можно говорить о постепенном самоотравлении катализатора при ф 0 8 в за счет блокирования прочно хемосорбированным органическим веществом активных мест. [10]
Исследуя металлические пленки, Бик [29] нашел, что азот хе-мосорбируется на пленке из чистого железа при температуре жидкого азота. Суммарная адсорбция СО на катализаторе 973 при - 183 приблизительно в два раза превышала количество азота, соответствующего монослою последнего при этой температуре; половину этого количества СО легко можно было откачать при - 78, так что эта часть, повидимому, адсорбирована физически. [11]
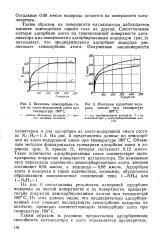 |
Величины хемосорбции газов из азото-водородной смеси при температуре 180 С.| Изотермы адсорбции водорода, снятые при температуре 180 С. [12] |
На рис. 5 представлены данные по хемосорбции из азото-водородной смеси при температуре 180 С. Объемным методом фиксировалась суммарная адсорбция азота и водорода ( рис. 5, кривая /), которая составляет 0 12 ммоль. Такое количество адсорбированных газов соответствует молекулярному покрытию поверхности катализатора. По изменению веса определяли количество хемосорбированного азота, которое составляет 0 04 ммоль, а водорода - 0 08 ммоль. [13]
Следовательно, при адсорбции газов, паров или растворенных веществ реальными активными углями нельзя все адсорбированное количество вещества относить к объему микропор и находить по предельной адсорбции Wo истинные характеристики микропористой структуры адсорбентов. Очевидно, что из суммарной адсорбции необходимо вычесть адсорбцию на поверхности мезопор, и лишь остаточное количество адсорбированного вещества действительно заполняет микропоры. [14]
Связующее объединяет отдельные кристаллики цеолита в гранулы, сохраняя возможность доступа молекул адсорбата к каждому из них, поскольку в гранулах создается вторичная пористость - так называемые транспортные поры. Дополнительная адсорбционная поверхность транспортных пор невелика и обычно не влияет на суммарную адсорбцию в грануле, кроме случаев, когда имеет место адсорбция насыщенных или пересыщенных паров веществ. Тогда транспортные поры могут заполняться адсорбатом частично или полностью по механизму капиллярной конденсации, и это дает существенный прирост суммарной адсорбции. [15]
Страницы: 1 2