Хромовый анод
Cтраница 1
Хромовый анод также может быть сделан пассивным, хотя его поведение несколько отличается от поведения металлов группы железа. При низких плотностях тока хромовый анод растворяется с образованием двухвалентных катионов Сг44, однако, когда он становится пассивным, растворение не прекращается, потенциал быстро возрастает приблизительно до 1 1 в, и хром переходит в раствор в шестивалентном состоянии, образуя ионы CtOt. Кислород не выделяется потому, что процесс Сг - СгО4 идет при менее положительном потенциале, чем выделение кислорода в том же растворе. Если электролит содержит ионы иода J -, то разряд этих ионов может происходить при еще более низком потенциале, а именно при 0.6 в; тогда хромовый анод, став пассивным, перестанет растворяться и на нем будет происходить выделение иода. Хром пассивируется в щелочном растворе легче, чем в кислом, и повышение температуры препятствует пассивации, так же как и для металлов группы железа; ионы хлора в случае хрома менее эффективно препятствуют переходу в пассивное состояние. Хромовый анод, став пассивным, без тока сохраняет это состояние в течение некоторого времени даже в кислом растворе, но активное состояние быстро возвращается при катодной поляризации. [1]
Кроме того, хромовые аноды переходят в раствор в виде ионов разной валентности, что усложняет работу. Поэтому при хромировании применяют аноды из свинца или смеси-свинца и сурьмы. [2]
Изучение изменения потенциала хромового анода во времени дает основание полагать, что момент достижения анодом устойчивого потенциала совпадает по времени с получением максимальной глубины каналов и не изменяющейся величины действительной поверхности покрытия. [3]
Применение растворимы: хромовых анодов невозможно из-за большой разницы катодноп и анодного выходов по току. Скорость растворения хромовы: анодов намного превышает скорость наращивания осадка, вслед ствие чего состав ванны быстро изменяется и получение нормаль ного покрытия становится невозможным. [4]
При наблюдениях за изменением потенциала хромового анода во времени каломельный электрод может быть заменен угольным. [5]
Кроме того, в процессе работы хромовые аноды переходят в раствор в виде ионов различной валентности, что усложняет работу электролита. [6]
Полученные результаты свидетельствуют о том, что при растворении хромового анода хром переходит в электролит не только в виде шестивалентных, но также и в виде трехвалентных ионов. [7]
Для проверки сделанного предположения были поставлены эксперименты по измерению потенциала хромового анода в процессе электролиза. [8]
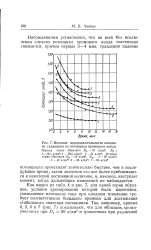
Наблюдениями установлено, что во всех без исключения случаях потенциал хромового анода постепенно снижается, причем первые 3 - 4 мин. [10]
Определение фосфора в меди рентгенофлуоресцентным методом [480] осуществляют на рентгеновском спектрографе с трубкой с тонкостенным окошком и хромовым анодом. [11]
Физико-химические свойства нефтей, такие как концентрация микрокомпонентов ( ванадий, кикель), величине комптоновоки и когерентно рассеюшого излучения хромового анода от проб нефти, позволяют осуществлять котроль за разработкой мвогогаюзтовых нефтяных месторождений. Комплексная разделяпцая функция, включавшая я себя описанные выше свойства нефти, позволяет создать модель каждого отдельного пластового флюида. Далее с помощью атих моделей иычнсляется доля соответствующего пласта в продукции совместных скваяш. [12]
Растворимые аноды ( из металлического хрома) при хромировании применять нецелесообразно, так как хром растворяется на аноде с ббльшим выходом по току, чем осаждается на катоде, хром с анодов переходит в раствор в виде ионов различной валентности и из-за хрупкости хромовые аноды трудно поддаются механической обработке, а следовательно, им не всегда можно придать нужную форму. [13]
Исходя из положения металлов в ряду напряжений, находим, что хром является более активным металлом ( Фсг - / Сг - 0 744 В) и в образующейся гальванической паре будет анодом. Хромовый анод растворяется, а на медном катоде выделяется водород. [14]
Электролиз в растворах хромовой кислоты осуществляется с нерастворимыми анодами. Применение растворимых хромовых анодов невозможно ввиду того, что анодный выход хрома по току в 6 - 8 раз выше катодного. Кроме того, при анодном растворении хрома в раствор наряду с шестивалентным хромом переходит трехвалентный. Благодаря этому в электролите непрерывно возрастает общая концентрация хрома и накапливаются значительные количества трехвалентных его соединений, что нарушает нормальное течение электролиза. [15]
Страницы: 1 2