Диссоциация - ионит
Cтраница 1
Диссоциация ионита сопровождается преодолением ионами фазового потенциала. Однако сумма работ по преодолений) фазового потенциала ионами, выходящими из ионита и входящими в него 2Ф2 равна нулю. Сам потенциал ф на границе набухшего геля и растворителя, вероятно, очень невелик. [1]
Диссоциация ионита - выделение ионов сопровождается преодолением ионами фазового потенциала. К этому следует добавить, что и сам потенциал ср на границе набухшего геля и растворителя, вероятно, очень невелик. [2]
Диссоциация ионита сопровождается преодолением ионами фазового потенциала. Однако сумма работ по преодолению фазового потенциала ионами, выходящими и входящими из ионита StpzF, равна нулю. Сам потенциал ф на границе набухшего геля и растворителя, вероятно, очень невелик. [3]
Диссоциацию ионитов в воде схематически можно представить. [4]
Упругость диссоциации ионита характеризует одно из важнейших его свойств - ту силу, с которой он преодоле вает торможение обратимого процесса ионного обмена, вызываемое обратной реакцией и зависящее от концентрации в растворе ионов, конкурирующих за место на поверхности ионита. [5]
Упругость диссоциации ионита зависит от природы химически активных групп, входящих составной частью в сложное строение зерна ионита, и от взаимной связи между электростатическими - силовыми полями зарядов, которые несут на себе названные группы. [6]
Степень диссоциации ионита и соответственно принадлежность его к сильным, слабым или полифункциональным ( амфотерным) электролитам определяется характером и соотношением числа ионогенных групп. [7]
Различная степень диссоциации ионитов зависит в основном от характера функциональных групп, поэтому последние иногда делят на сильно - и слабокислотные и сильно - и слабоосновные. Такая классификация правомерна при условии, что у сравниваемых ионитов остальная часть молекулы ( скелет ионита) имеет сходное строение. Необходимо иметь в виду, что, помимо характера функциональной группы, на степень диссоциации ионита влияет ( иногда весьма резко) также и структура скелета, вызывая понижение или повышение кислотных и основных свойств функциональных групп. [8]
С-отрицательный логарифм кажущейся константы диссоциации ионита; п - постоянная, характеризующая степень структурирования полимера; а - степень диссоциации ионогенных групп. [9]
Если теперь каждую из констант сопряженных процессов диссоциации ионитов представить чер - з величины, характеризующие энергию взаимодействия ионов и молекул с растворителем ( изменение изобарного потенциала), как это было сделано нами раньше по отношению к раство имым кислотам, то можно установить, как будет зависеть константа ионного обмена / С0бм, а следовательно, и селективность от свойств ионита и растворителя. [10]
Если теперь каждую из констант сопряженных процессов диссоциации ионитов представить через величины, характеризующие энергию взаимодействия ионов и молекул с растворителем ( изменение изобарного потенциала), как это было сделано раньше по отношению к растворимым кислотам, то можно установить, как будет зависеть константа ионного обмена Коба, а следовательно, и селективность от свойств ионита и растворителя. [11]
В случае ионитов слабокислотного и слабоосновного типов сильное влияние на процесс набухания может оказывать степень диссоциации ионита. [12]
Для слабокислотных катионитов ион Н, а для низкоосновных анионитов ион ОН - перемещаются правее в зависимости от степени диссоциации ионитов в процессе ионного обмена. [13]
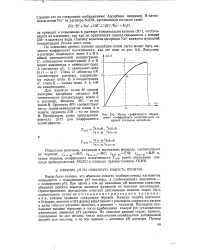 |
Метод графического определения коэффициента селективности по кривой изотермы адсорбции. [14] |
При одном и том же изменении рН величина снижения обменной емкости ионитов является функцией их констант диссоциации. Ориентировочное определение констант диссоциации ионитов может быть осуществлено путем их потенциометрического титрования, которое проводят следующим образом. Навеску ионита ( катионит в Н - форме, анионит в ОН-форме) взбалтывают с раствором хлористого натрия и далее титруют катионит щелочью, а анионит - кислотой. Последние прибавляют малыми порциями и после прибавления каждой ( по установлении равновесия) замеряют рН раствора. По опытным данным строят кривую, откладывая по оси абсцисс числа миллиграмм-эквивалентов добавленной щелочи или кислоты, а по оси ординат - значения рН раствора. [15]
Страницы: 1 2