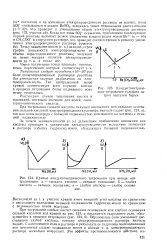
Диссоциация - слабая кислота
Cтраница 3
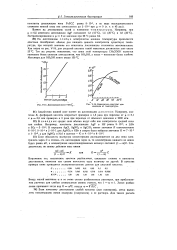 |
Диссоциация иона TINO I.| Зависимость констант диссоциации от температуры. [31] |
Зная константу диссоциации слабой кислоты ( или основания), легко вычислить концентрацию ионов водорода ( гидроксила) в ее растворе. [32]
Обратимые реакции диссоциации слабых кислот по Аррениусу характеризуются константами диссоциации кислот Кдк. [33]
Зная константу диссоциации соответствующей слабой кислоты или основания, нетрудно вычислить рН образуемых ими буферных смесей. Выведем формулы, применяемые при указанных вычислениях. [34]
Так как степень диссоциации слабых кислот возрастает пропорционально температуре, то хлоргидринирование при повышенных температурах идет, в принципе, хуже. [35]
При этом константа диссоциации слабой кислоты берется по второй ступени, так как в результате гидролиза получаются анионы НСО3 -, образующиеся из СО3 - - и Н - ионов воды. [36]
Ниже приведены константы диссоциации слабых кислот и коэффициенты п, характеризующие увеличение растворимости в одномолярном растворе сильной кислоты. [37]
 |
Диссоциация слабой кислоты. [38] |
Результаты по рассмотрению диссоциации слабой кислоты приведены втабл. [39]
Требуется знать константы диссоциации слабой кислоты, титруемой сильным основанием ( 1), или слабого основания, титруемого сильной кислотой ( 2), а также концентрацию образующей соли. [40]
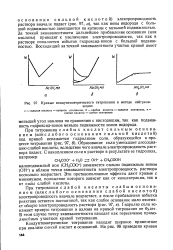 |
Кривые кондуктометрического титрования в методе нейтрализации. [41] |
Образование соли уменьшает диссоциацию слабой кислоты, вследствие чего вначале электропроводность раствора падает. [42]
Образование соли уменьшает диссоциацию слабой кислоты, поэтому электропроводимость раствора вначале падает. [44]
Поскольку гидролиз определяется диссоциацией слабой кислоты и воды, то константу гидролиза удобно связать с константой ионизации кислоты и ионным произведением воды. [45]
Страницы: 1 2 3 4