Кадмиевый анод
Cтраница 1
Поверхность кадмиевых анодов должна быть в 1 5 - 2 раза больше поверхности катода. [1]
Окиснортутно-кадмиевый элемент содержит кадмиевый анод ( аналогичный тому, который применяется в никель-кадмиевом элементе), окиснортутный катод и раствор КОН в качестве электролита. Батареи выпускаются в призматическом или дисковом исполнении. Напряжение разомкнутой цепи этих элементов составляет - 0 9 В, а рабочее напряжение находится в диапазоне 0 75 - 0 9 В в зависимости от величины нагрузки. Удельная энергия по массе для ртутно-кадмиевых систем лежит в интервале 44 - 66 Вт - ч / кг и зависит от интенсивности разряда. Элемент с системой окись ртути - кадмий отличается хорошей стабильностью, поскольку оба электрода проявляют высокую стойкость к растворению в электролите. [2]
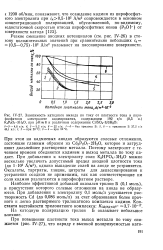 |
Зависимость катодного выхода по току от плотности тока в пиро-фосфатном электролите кадмирования, содержащем 192 г / л ( 0 5 н. K PzOr-SHjO, при. рНж8 и различном содержании CdSO4 - 8 / 3H2O. [3] |
При этом на кадмиевых анодах образуются солевые отложения, состоящие главным образом из Cd2P2O7 - 2H2O, которое и затрудняют дальнейшее растворение металла. Поэтому электролит с течением времени обедняется кадмием и выход металла по току падает. При добавлении к электролиту соли КдНРО - ЗНгО можно несколько увеличить допустимый предел анодной плотности тока ( до 1 - Ю2 А / м2), однако выпадение солей на аноде не устраняется. Оксалаты, тартраты, глицин, цитраты для депассивирования и устранения осадков не применимы, так как соответствующие им соли кадмия разлагаются в пирофосфатном растворе. [4]
В электролитической ячейке с кадмиевым анодом и платиновым катодом находится раствор НС1, окрашенный метилоранжем в красный цвет. В результате электролиза растворяется кадмий и вблизи анода образуется слой раствора CdCl2, который приобретает желтый цвет, свойственный метилоранжу в нейтральных растворах, так как ионы водорода из прианодного пространства уходят к катоду. [5]
 |
Электродные потенциалы. [6] |
В некоторых случаях целесообразно использовать кадмиевый анод. В частности, при анализе малых концентраций кислорода ниже 4 35 мг / л, когда потенциал золотого катода, обусловленный поляризацией в результате замыкания с цинковым анодом, сдвигается до значений, при которых возможно выделение водорода, потенциал, сообщаемый золотому катоду кадмиевым анодом, будет еще далек от потенциала начала выделения водорода. [7]
Проводят электролиз раствора LiCI с платиновым катодом и кадмиевым анодом. [8]
В электролизер наливают один из вышеуказанных растворов и помещают кадмиевые аноды. В качестве катода используют или кадмий, хорошо очищенный и протравленный в 3 % - ном растворе НС1, или платину, предварительно покрытую кадмием в электролите: CdSO4 - 8 / 3H2O - 64 г-л 1 - ( NH4) 2S04 - 33 г-л 1; A12 ( SO4) 3 - 18Н2О - 28 г-л 1; желатин-0 5 г-л 1 ( стр. [9]
Металл осаждается главным образом из цианистых растворов с применением кадмиевых анодов. Осаждение обычно происходит при температуре 20 - 35 С; КПД равен 90 - 95 %; рассеивающая способность хорошая. В обычной ванне получают осадки тусклого цвета, а в ваннах, содержащих добавки - блестящие покрытия. [10]
Проводят электролиз раствора соли LiCl с платиновым катодом и растворимым кадмиевым анодом. При электролизе ионы С1 - идут к аноду, однако, на аноде происходит окисление кадмия, а не ионов хлора. При этом ионы Cd2 переходят в раствор. Количество ионов С1 - в анодном пространстве растет, в катодном убывает. [11]
Основными материалами, применяемыми при цинковании и кадмировании, являются цинковые и кадмиевые аноды. [12]
Частым явлением при кадмировании является обогащение ванны металлом из-за растворения кадмиевых анодов в сильно концентрированной цианидной ванне не только при электролизе, но и во время простоя ванны. В таких случаях необходимо часть кадмиевых анодов изъять из ванны. Оборудование ванны избыточным количеством кадмиевых анодов всегда приводит к чрезмерному накоплению металла в ванне. [13]
Для получения спектрально чистого кадмия можно применить также электролиз с алюминиевым катодом и кадмиевым анодом. [14]
Выход по току более 100 % был найден также Байтом [43] при исследовании растворения кадмиевого анода, в нитратном растворе. [15]
Страницы: 1 2 3 4