Диссоциация - многоосновная кислота
Cтраница 2
Известно, что диссоциация многоосновных кислот и многокислотных оснований происходит по ступеням. [16]
Важно подчеркнуть, что диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей мере по второй и лишь в незначительной степени - по третьей. [17]
Такое соотношение величин констант диссоциации многоосновных кислот дает возможность пренебрегать небольшой долей концентрации ионов Н, которая образуется за счет диссоциации по второй ступени, и вести расчет рН раствора, рассматривая многоосновную кислоту как одноосновную. Так, например, в 0 01 М растворе H2S2 5 - 10 - 5 г-мол / л ионов водорода образуются за счет диссоциации по первой ступени и только около 1 0 - 10 - 14 г-мол / л - за счет диссоциации по второй ступени. [18]
 |
Значения констант диссоциации важнейших кислот в воде. [19] |
В скобках указаны степени диссоциации многоосновных кислот. [20]
Равновесия образования комплексных ионов и диссоциации многоосновных кислот идентичны. Записываются они обычно так, чтобы показать образование иона, а не его диссоциацию. [21]
Приведенные выше рассуждения приложили к любой ступени диссоциации многоосновной кислоты, если константа диссоциации данной ступени отличается на множитель 103 или более от константы диссоциации непосредственно предшествующей или последующей ступени диссоциации. Поправка на активность, согласно уравнению ( 28), зависит от зарядов частицы недиссоциированной кислоты и соответствующего аниона. [22]
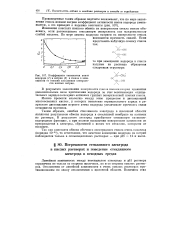 |
Коэффициент активности ионов / Si-UNa. [23] |
Можно провести аналогию между этим процессом и диссоциацией многоосновных кислот, у которых появление отрицательного заряда в результате диссоциации первого атома водорода увеличивает прочность связи оставшихся протонов. [24]
Можно провести аналогию между этим процессом и диссоциацией многоосновных кислот, у которых появление отрицательного заряда в результате диссоциации первого водорода увеличивает прочность связи оставшихся протонов. [25]
Распад комплексных ионов носит ступенчатый характер, аналогично диссоциации многоосновных кислот. Сначала отщепляется один адденд, затем другой и так далее. [26]
Диссоциация комплексных ионов всегда протекает по стадиям аналогично диссоциации многоосновных кислот и их солей. Поэтому приведенные в табл. 16.4 данные оценивают только суммарную устойчивость внутренней сферы комплексов. [27]
Для расчета констант устойчивости координационных соединений и констант диссоциации многоосновных кислот обычно используют специальный математический аппарат, учитывающий одновременное протекание нескольких процессов ступенчатого комплексообразования или ступенчатой диссоциации кислот. [28]
Потенциометрически могут быть определены отдельные константы равновесия в случае диссоциации многоосновных кислот или образования комплексных ионов. Титруя раствор, содержащий один продукт реакции, раствором, содержащим другой в присутствии индикаторного электрода, обратимого относительно иона, входящего по крайней мере в один из продуктов, можно найти концентрацию этого иона при различных условиях. [29]
Во всех случаях, когда значения рКа для последовательных стадий диссоциации многоосновной кислоты отличаются друг от друга на три-четыре единицы ( как это почти всегда имеет место на самом деле), рассмотрение состава раствора удается значительно упростить. [30]
Страницы: 1 2 3 4