Термическая диссоциация
Cтраница 2
Термическая диссоциация СО2 и Н2О также не может явиться причиной химической неполноты горения, так как продукты диссоциации при их охлаждении вновь ассоциируются. [16]
Термическая диссоциация K2S2O5 начинается при температурах 105 - 1 10 С. [17]
Термическая диссоциация карбонилов на металл и окись углерода в большинстве случаях наступает при относительно невысокой температуре. Так, пары карбо-пила никеля начинают распадаться на металл и окись углерода ниже температуры кипения этого соединения. [18]
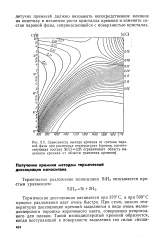 |
Зависимость выхода кремния от состава паровой фазы при различных температурах ( кривая, соответствующая составу Si / Cl0 25 ограничивает область выделения кремния от области травления кремния. [19] |
Термическая диссоциация начинается при 370 С, а при 500 С процесс разложения идет очень быстро. При столь низких температурах диссоциации кремний выделяется в виде очень мелкодисперсного порошка коричневого цвета, совершенно непригодного для плавки. [20]
Термическая диссоциация гидридов ЭН2 начинает становиться заметной около 600 С, причем по ряду Са-Sr - Ва она несколько усиливается. Расплавленный СаН2 способен растворять металлический кальций. [21]
Термическая диссоциация гидридов 3H: j начинает становиться заметной около 600 С, причем по ряду Са-Sr - Ва она несколько усиливается. Расплавленный СаН2 способен растворять металлический кальций. [22]
Аналогичная термическая диссоциация коричнево-красного FeBr3 идет гораздо легче ( атмосферное давление брома достигается при 139 С), а йодное железо неустойчиво уже при обычной температуре. В твердом состоянии оно не получено, но в газовой фазе при избытке иода, по-видимому, существовать может. [23]
Термическая диссоциация галогеноводородов по общему уравнению 2НХ Н2 - Ь Х2 очень сильно возрастает от хлористого водорода к йодистому водороду. В то время как для хлористого и бромистого водорода при 300 распад на составные части еще не может быть прямо обнаружен, для йодистого водорода при этой же температуре он уже весьма значителен. Следующее отсюда сильное уменьшение сродства галогенов к водороду с возрастанием атомного веса проявляется также в значительном уменьшении теплот образования от фтористого водорода к йодистому. [24]
 |
Вероятное строе - г г т г. [25] |
Термическая диссоциация кислорода под обычным давлением становится заметной приблизительно с 2000 С, достигает 1 % около 2300 ЬС и проходит почти нацело при 5000 С. [26]
Термическая диссоциация галогеноводородов по общему уравнению 2HX iH2 - ( - - f - Х2 очень сильно возрастает от хлористого водорода к йодистому водороду. В то время как для хлористого и бромистого водорода при 300 распад на составные части еще не может быть прямо обнаружен, для йодистого водорода при этой же температуре он уже весьма значителен. Получающееся отсюда сильное уменьшение сродства галогенов к водороду с возрастанием атомного веса проявляется также в значительном уменьшении теплот образования от фтористого водорода к йодистому. [27]
Термическая диссоциация галогеноводородов по общему уравнению 2НХ Н2 Х2 очень сильно возрастает от хлористого водорода к йодистому водороду. В то время как для хлористого и бромистого водорода при 300 распад на составные части еще не может быть прямо обнаружен, для йодистого водорода при этой же температуре он уже весьма значителен. Получающееся отсюда сильное уменьшение сродства галогенов к водороду с возрастанием атомного веса проявляется также в значительном уменьшении теплот образования от фтористого водорода к йодистому. [28]
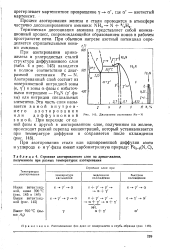 |
Строение азотированного слоя на армко-железе, полученного при разных температурах азотирования.| Диаграмма состояния Fe - N. [29] |
Термическая диссоциация аммиака представляет собой ионизационный процесс, сопровождающийся образованием ионов в рабочем пространстве печи. При обычном нагреве азотный потенциал определяется отрицательными ионами аммиака. [30]
Страницы: 1 2 3 4