Полная диссоциация - молекула
Cтраница 1
Полная диссоциация молекул, содержащих определяемый элемент, может быть достигнута удалением компонента X из сферы реакции. [1]
Полная диссоциация молекул воздуха наступает только при давлениях, меньших одной атмосферы. Для более высоких давлений при температуре 8 000 К еще содержится некоторое количество недиссоциированных молекул, а при давлении в несколько сотен атмосфер около 50 % молекул остаются недиссоциированными. [2]
Вследствие полной диссоциации молекул сильных электролитов на ионы в растворе оказывается сравнительно высокая концентрация ионов. Между положительными и отрицательными ионами возникает электростатическое взаимодействие, вследствие чего их эффективные концентрации оказываются меньше действительных. Влияние электростатического взаимодействия между ионами учитывается тремя коэффициентами: активности, осмотическим и электропроводности. [3]
Значит тепловой эффект полной диссоциации молекулы на свободные атомы приравниваем атомарной теплоте образования. [4]
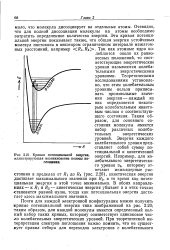 |
Кривая потенциальной энергии, иллюстрирующая возникновение полосы поглощения. [5] |
Очевидно, что для полной диссоциации молекулы на атомы необходимо затратить определенное количество энергии. Ri, Rz - Так как атомные ядра колеблются около их равновесных ( положений, то соответствующие энергетические уровни называются жоле ба-тельными энергетическими уровнями. [6]
 |
Зависимость эквивалент ной электропроводности растворов электролитов от степени разбавления. [7] |
В бесконечно разбавленном растворе достигается полная диссоциация молекул ( а1) и взаимодействие между ионами отсутствует. Каждый из ионов движется независимо от других и эквивалентная электропроводность в таком случае может быть представлена как сумма электропроводностей ионов. Та часть эквивалентной электропроводности, которая приходится на ионы одного вида, называется подвижностью иона. [8]
С увеличением концентрации раствора при полной диссоциации молекул электролита количество ионов в растворе значительно возрастает, что приводит к увеличению ионной силы раствора и значительному уменьшению коэффициентов активности ионов. Рендель нашли закон ионной силы, согласно которому коэффициенты активности ионов одной и той же зарядности одинаковые во всех разбавленных растворах, имеющих одинаковую ионную силу. [9]
С увеличением концентрации раствора при полной диссоциации молекул электролита количество ионов в растворе значительно возрастает, что приводит к увеличению ионной силы раствора и значительному уменьшению коэффициентов активности ионов. Рендель нашли закон ионной силы, согласно которому коэффициенты активности ионов одной и той же заряд-ности одинаковые во всех разбавленных растворах, имеющих одинаковую ионную силу. [10]
Необходимым условием протекания указанных реакций является полная диссоциация молекулы кислорода на атомы или разрыв одной простой связи в молекуле Оа. Энергия активации первой реакции ( 117 000 кал / Моль) выше энергии связи С-С ( 92 000 кал / моль), что делает мало достоверной всю гидроксильную теорию в целом. [11]
Молекула АВ начинает образовываться еще до полной диссоциации молекулы ВС, причем энергия образования новой связи используется частично для разрыва старой связи. [12]
Молекула АВ начинает образовываться еще до полной диссоциации молекулы ВС, причем энергия образования новой связи используется частично для разрыва старой связи. [13]
Хотя в кристалле поваренной соли имеет место полная диссоциация молекул Na Gl - на ионы, тем не менее электропроводность его при абсолютном нуле температуры равна нулю в противоположность электропроводности металлов, которая в этом случае становится, наоборот, бесконечной. [14]
Поскольку температура атомизаторов не всегда достаточна для полной диссоциации молекул всех соединений и полного испарения всех веществ, на концентрацию свободных атомов определяемых элементов влияют другие компоненты пробы. Они могут образовывать с атомами определяемых элементов более тугоплавкие или труднодиссоциирующие соединения или, наоборот, высвобождать их из соединений. [15]
Страницы: 1 2 3 4