Ступенчатая диссоциация
Cтраница 1
Ступенчатая диссоциация обусловливает возможность образования кислых и основных солей. [1]
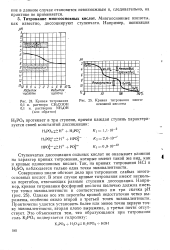 |
Кривая титрования. [2] |
Ступенчатая диссоциация сильных кислот не оказывает влияния на характер кривых титрования, которые имеют такой же 1вид, как и кривые одноосновных кислот. Так, на кривых титрования НС1 и H2SO4 наблюдается только одна точка эквивалентности. [3]
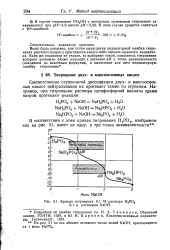 |
Кривая титрования 0 1 М раствора Н3Р04 0 1 н. раствором NaOH. [4] |
Соответственно ступенчатой диссоциации двух - и многоосновных кислот нейтрализация их протекает также по ступеням. [5]
Подобно ступенчатой диссоциации электролитов, первые ступени сольватационного равновесия и отвечающего ему кислотно-основного равновесия более резко выражены, чем последующие. [6]
Ступенчатой диссоциацией кислот объясняется образование кислых солей. [7]
Их ступенчатая диссоциация обусловливает образование кислых и основных солей. [8]
Продукты ступенчатой диссоциации следует рассматривать как комплексы. В растворе эти комплексы координационно насыщены за счет присоединения к центральному атому молекул растворителя. [9]
Продукты ступенчатой диссоциации координационно-насыщенных по данному лиганду соединений как комплексы были рассмотрены А. К. Бабко и Силленом. [10]
При ступенчатой диссоциации каждая ступень имеет свою константу электролитической диссоциации ( см. приложение, стр. [11]
При ступенчатой диссоциации электролитов каждая ступень характеризуется своей константой диссоциации. Так как константы диссоциации последующих ступеней очень малы сравнительно с константой диссоциации первой ступени, то обычно ведут расчет по константе диссоциации первой ступени. [12]
Примером ступенчатой диссоциации основания, содержащего в молекуле более одной гидроксильной группы, может служить гидроокись кальция. [13]
 |
Константы диссоциации К некоторых слабых электролитов ( при 25 С. [14] |
При ступенчатой диссоциации многоосновных кислот отщепление последующих ионов водорода затрудняется вследствие увеличения отрицательного заряда аниона и энергии связи иона водорода с анионом. Аналогичное явление наблюдается также при диссоциации солей. [15]
Страницы: 1 2 3