Менее активный восстановитель
Cтраница 1
Менее активные восстановители, к которым нужно отнести простые вещества, дающие галогениды с небольшими тсплотамн образования, иногда находят некоторое применение для получения низших галогепндов. Особенно удобно применять серу, так как продукт реакции - хлорид серы - легко отделяется о г галоге-нидов, имеющих обычно более высокие температуры испарения. [1]
 |
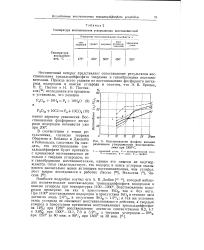
Зависимость массы покрытия ( т от продолжительности серебрения ( t при температуре, С. [2] |
При применении сегнетовой соли, которая является менее активным восстановителем, чем глюкоза, серебро в объеме раствора образуется медленнее, но закономерности его восстановления принципиально не меняются. [3]
 |
Температура воспламенения углеродистых восстановителей.| Восстановление фосфата кальция различными углеродистыми восстановителями при 1300 С. [4] |
Опыт свидетельствует, что водород и окись углерода оказываются значительно менее активными восстановителями, чем углерод. [5]
Аналогичная же реакция с ионом Вг - не протекает, так ка последний является значительно менее активным восстановителем чем ион иода. [6]
Аналогичная же реакция с ионом Вг - не протекает, так как последний является значительно менее активным восстановителем, чем йодид-ион. [7]
Восстановительная активность элементов ПА-подгруппы увеличивается от бериллия к радию, но в целом все они - несколько менее активные восстановители, чем щелочные металлы; только барий не уступает по активности щелочным металлам. [8]
 |
Свойства металлов НА-группы. [9] |
Восстановительная активность элементов ПА-группы увеличивается от берилия к радию, но в целом все они - несколько менее активные восстановители, чем щелочные металлы; только барий не уступает по активности щелочным металлам. [10]
Это менее активный восстановитель и серебро в объеме раствора образуется медленнее. Указывают [6], что целесообразно использовать смесь глюкозы и тартрата. [11]
Это менее активный восстановитель, и серебро в объеме раствора образуется медленнее. Закономерности восстановления серебра тартра-том и глюкозой сходны. [12]
Цинк, кадмий и ртуть образуют побочную подгруппу II группы. Поэтому цинк, кадмий и ртуть являются менее активными восстановителями. [13]
Как и следует ожидать, амины гораздо чаще получают из ами-дов, а не из гидразидов кислот. Для восстановления амидов в основном применяется гидрид металла, например алюмогидрид лития [ 74tr Как правило, эта реакция приводит к образованию амина с тей же числом атомов углерода. Однако, если применять ограниченное количество алюмогидрида лития или менее активный восстановитель, например диэтокси - или триэтоксиалюмогидрид лития, можно получить некоторое количество альдегида ( гл. Амиды - производные этиленимина [75], карбазола [76], М - метил-анилина [77] и имидазола [78] - дают значительные выходы альдегида. [14]
Цинк, кадмий и ртуть образуют подгруппу цинка II группы периодической системы. Их атомы, как и атомы всех элементов этой группы, имеют во внешнем слое 2 электрона, но в предпоследнем - 18, а не 8, как атомы магния и щелочноземельных металлов. Этим и объясняется различие в свойствах элементов главной ( Be, Mg, Ca, Sr, Ba и Ra) и побочной ( Zn, Cd и Hg) подгрупп. Цинк, кадмий и ртуть являются менее активными восстановителями и характеризуются склонностью к образованию комплексных соединений. [15]
Страницы: 1 2