Восстановление - дисульфидная связь
Cтраница 1
Восстановление дисульфидной связи представляет собой одну из самых мягких, максимально специфичных и наиболее легко обратимых реакций белков. [1]
 |
Структура нейротоксина длинного типа а-бунгаротоксина из яда кранта Bungarus muliicincius. [2] |
Восстановление дисульфидных связей приводит к полной потере биологической активности, а повторное окисление частично восстанавливает первоначальную активность токсинов. [3]
Восстановлением дисульфидных связей и их последующим реокислением был получен проинсулин с - 70 % - ным выходом. На рис. 2 - 41 приведена первичная структура проинсулина свиньи, состоящего из 84 аминокислот. В процессе биосинтеза на первом этапе образуется фрагмент, содержащий в соответствии с так называемой сигнальной гипотезой ( разд. N-концевую сигнальную последовательность с информацией о том, что последующая последовательность проиисулина строится прямо на мембране эндоплазматического ретикулума и что этот инсулиновый предшественник уже в процессе синтеза должен уходить через мембрану по внутренним каналам ЭР. Еще во время биосинтеза сигнальный пептид отщепляется особой сигнальной пептидазой. Проинсулин затем идет в аппарат Гольджи, где расщепляется на инсулин и С-пелтид и в кристаллической форме в присутствии цинка накапливается в визикулах. При соответствующем физиологическом раздражении происходит экзоцитоз и содержимое визикул попадает в кровь. [4]
При восстановлении дисульфидной связи алюмогидридом лития или смесью цинка и кислоты образуются две молекулы тиола. Однако этот метод редко применяют для синтеза тиолов, а наоборот, дисульфиды получают из тиолов. [5]
При восстановлении дисульфидной связи образуется дигидролипоевая кислота. [6]
Первона - ч альное восстановление дисульфидных связей проводят путем добавления 0 62 мл 1 0 М раствора Na2SOs ( или 1 25 мл 0 5 М Na2SO3 в 8 М мочевине) при рН 7 4 в течение 10 мин. Освобождающиеся SH-группы затем вновь окисляют, добавляя либо 1 25 мл 0 5 М раствора иодозобензоата в 8 М растворе мочевины, либо 1 25 мл 0 5 М тетратионата Na в 8 М растворе мочевины. Через 10 мин повторяют обработку раствора белка сульфитом Na и завершают циклы окислительно-восстановительных процессов. S-сульфопротеин выделяют из обессоленного раствора путем лиофилизации. [7]
Тиализильная пептидная связь, получающаяся в результате восстановления дисульфидных связей и S-аминоэтилирования образовавшегося остатка цистеина, также расщепляется трипсином ( см разд. Природа R имеет второстепенное значение, хотя связи Arg-Pro и Lys-Pro не разрываются. Известны и многие другие протеиназы, которые по своей специфичности напоминают трипсин. Например, известно, что тромбин разрывает участки Arg-Gly и Arg-Ser в фибриногене - одном из своих природных субстратов, однако для эффективного катализа необходима еще и связь фермента со вторым участком молекулы субстрата. Поэтому тромбин находит лишь ограниченное применение при расщеплении пептидных связей с целью изучения последовательности, хотя в случае секретина он разрывает связь Arg-Asp, в то время как три связи Arg-Leu остаются незатронутыми. Действие трипсина можно ограничить так, чтобы он разрывал либо по остаткам аргинина, либо по остаткам лизина. [8]
Участие аминокислот в образовании активного каталитического центра удалось внимательно исследовать в рибонуклеазе. Рибонуклеаза состоит только из одной пептидной цепи из 124 остатков аминокислот, последовательность которых довольно хорошо изучена. При восстановлении дисульфидных связей образуется 8 SH-групп и фермент теряет свою активность. Восстановленную рибонуклеазу можно окислить воздухом при рН 7, и тогда ее активность возвращается в большой мере. [9]
Дитиотрейтол ( Dithiothreitol) Низкомолекулярный ти-олсодержащий восстанавливающий агент. Добавляется в буферные растворы в низкой концентрации для предотвращения окисления сульфгидрильных групп в белках. В высоких концентрациях используется для восстановления дисульфидных связей. [10]
Уменьшение активности также наблюдается после восстановления дисульфидных связей в сульфгидрильные группы. [11]
А - занимает промежуточное положение и появляется в ответ на быструю потребность организма в инсулине. Строго говоря, инсулин не имеет специфического плазменного белка-переносчика. Время его полужизни в кровеносном русле составляет 3 - 5 мин. Для этого требуются две ферментативные системы: инсулинспецифичная протеиназа печени и других тканей и печеночная глутатионинсу-линтрансгидрогеназа, катализирующая восстановление дисульфидных связей; это обеспечивает более легкий протеолиз отдельных А-и 5-цепей инсулина. [12]
Часто перед исследователями встает задача селективного выделения из суммарного гидролизата белка пептидов, несущих определенные функциональные группы. Для этих целей может быть эффективно использована хемоспецифическая, или ко валентная, хроматография, основанная на образовании ко валентной связи пептида с носителем. Чаще всего метод ковалентной хроматографии применяют для селективного аыделения иистеинсодержащих пептидов. При этом пептиды, не содержащие остатков цистеина, не саязываются с носителем и удаляются при промывании соотаетстаующим буфером. Цистеинсодержащие пептиды выделяют далее восстановлением дисульфидных связей при рН 8 0 избытком меркаптоэтанола или дитиотреита. Более селективного разделения тиолсодержащих и тиолнесодержащих пептидов можно достигнуть, если проводить ферментативный или химический гидролиз белка, предварительно иммобилизованного иа нерастворимом носителе. В качестве носителя в обоих случаях используется тиол-сефароэа 4В, которая содержит в качестве активированной группы смешанный дисульфид, образующийся при обработке глу-татион-сефарозы 2 2 -дипиридилдисульфидом. [13]
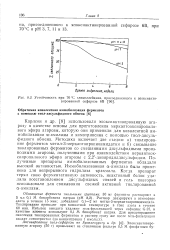 |
Устойчивость при 70 С глициллейцина, присоединенного к эпоксиактивированной сефарозе 6В. [14] |
Карлсон и др. [8] использовали эпоксиактивированную ага-розу в качестве основы для приготовления меркаптооксипропило-вого эфира агарозы, которую они применили для ковалентной иммобилизации сс-амилазы и химотрипсина с помощью тиол-дисульфидного обмена. Иммобилизованная а-амилаза была применена для непрерывного гидролиза крахмала. Когда препарат терял свою ферментативную активность, неактивный белок удаляли восстановлением дисульфидных связей и гель повторно использовали для связывания свежей активной тиолированной яс-амилазы. [15]
Страницы: 1 2