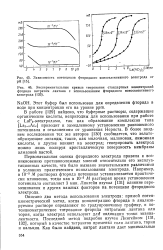
Время - установление - потенциал
Cтраница 3
Измерение рН с помощью лабораторных рН - метров в открытых сосудах сопряжено с возможностью возникновения значительных погрешностей, поскольку анализируемая вода характеризуется повышенной чувствительностью к загрязнениям при контакте с атмосферой, через электролитический ключ вспомогательного электрода и из-за частичного растворения мембраны измерительного электрода. Последнее особенно проявляется при измерении рН в воде высшей чистоты, когда время установления потенциала стеклянного электрода резко увеличивается и приэлектродный слой жидкости обогащается щелочными ионами, вымываемыми из стекла мембраны вследствие высокой растворяющей способности чистой воды. [31]
Изучены многие факторы, влияющие на качество мембранного электрода, а именно: размеры частиц порошка меди, порошка серы, давление, температура, природа газовой атмосферы во время отжига и техника полировки. Когда в формуле Cu2 S, которая описывает состав керамики из сульфида меди, увеличивали х, уменьшалось время установления потенциала электрода и усложнялся процесс изготовления непористой керамики. [32]
Мембраны для Т1 - селективных электродов изготавливают на основе таллиевой соли молибдофосфорной ( Т1 - Мо - Р) или вольфрамофосфорной ( Т1 - W - Р) кислот в матрице из эпоксидной смолы. В области рН 1 - н4 потенциал электрода возрастает и затем остается постоянным от рН 4 до рН 6; время установления потенциала электрода - около 2 мин; температурный коэффициент равен 0 27 мВ / С. [33]
Имеющийся в настоящее время опытный материал по стационарной анодной поляризации электрода еще не позволяет делать широких выводов. Следует также иметь в виду, что определение максимальной плотности тока в связи с чрезвычайно большим ( в этом случае) временем установления потенциала электрода, в свою очередь обусловленным его большой химической емкостью, ненадежно; благодаря этому измерения в области г / / макс. [34]
Первоначальная оценка фторидного электрода привела к возникновению противоположных мнений относительно его эксплуатационных качеств, что было вызвано значительными различиями в условиях практического использования электрода. Например, в 10 - 3 М растворах фторида потенциал устанавливается практически мгновенно, тогда как в 10 - 5 M растворах время установления потенциала составляет 3 мин. Лингейн изучал [131] влияние перемешивания и других важных факторов на. [36]
 |
Серебряный электрод. [37] |
В связи с тем что величина рН стоков влияет на скорость реакции окисления растворенных цианидов в цианаты и время окисления может колебаться от нескольких секунд до нескольких минут, скорость установления на электроде потенциала также должна лежать в указанных пределах, особенно при автоматическом регулировании подачи обезвреживающего реагента. Экспериментальные исследования, проведенные Азендорфом [22], подтвердили, что путем выбора соответствующего металлического измерительного электрода, обратимого по отношению к иону циана в растворе, и подбора определенной его формы можно добиться того, что время установления потенциала на электроде будет соответствовать продолжительности реакций обезвреживания цианидов. При интенсивном перемешивании их продолжительность составляет от 3 до 10 мин. [38]
Установление равновесного потенциала связано с обменом между металлом и его ионами в растворе. Таким образом, для установления равновесного потенциала на металлическом электроде необходимо присутствие его ионов в растворе и отсутствие побочных обменных реакций. Время установления потенциала зависит от скорости обмена. [39]
Однако качественная картина происходящих процессов может быть проанализирована. При изменении любой токовой нагрузки на рельсовой сети электромагнитное возмущение распространяется в среде за пренебрежимо малое время. Время установления составляющих потенциалов, определяющееся переходом проводящей среды от состояния, характеризующегося одним распределением тока, к состоянию, соответствующему другому распределению тока, зависит от параметров, характеризующих среду. Это значит, что омическая составляющая потенциала устанавливается в пренебрежимо малое время TI и перераспределение омической составляющей потенциала происходит со скоростью изменения поля блуждающих токов. [40]
Кроме того, емкость С играет роль элемента памяти, определяющего направление переброса схемы, когда триггер оказывается в состоянии неустойчивого равновесия. С этой точки зрения величина С1 должна быть также достаточно большой, чтобы постоянная времени ее перезаряда была во всяком случае не меньше длительности запускающих импульсов. Однако чрезмерное увеличение емкости ускоряющего конденсатора невыгодно, так как это приводит к увеличению времени установления потенциала в схеме в процессе переброса. [41]
Проблема теоретического обоснования времени отклика в общем виде до настоящего времени не решена, но отдельные авторы предлагают приближенные выражения для зависимости потенциала от времени. Поскольку потенциал зависит от нескольких процессов, происходящих на поверхности и в объеме мембраны, то время установления потенциала должно быть сложной функцией ряда кинетических параметров. [42]
Следует заметить, что Cu-селективные электроды с жидкостными мембранами в значительной степени уступают поликристаллическим мембранным электродам. Градуировочный график электрода в водных растворах линеен в интервале концентраций Си2 10 - - 10 - 5 М, угловой коэффициент близок к теоретическому, время установления потенциала 15 мин, срок службы электрода 6 мес. В неводных растворах характеристики электрода заметно ухудшаются: увеличивается время отклика электрода, наблюдается дрейф потенциала. Методом смешанных растворов найдены коэффициенты селективности электрода, показано, что мешающее действие оказывают ионы бария и железа. [43]
 |
Поляризационная кривая растворения железа в щелочи. [44] |
А / м2 железо вновь переходит в активное состояние в результате растворения в щелочи пассивирующего слоя. Явление растворения пассивирующего слоя наблюдается и при аноднвм растворении цинка в растворах NaOH. После перевода металла в пассивное состояние и выключения тока на нем устанавливается положительный потенциал, который с течением времени смещается в отрицательную сторону до стационарного. Время установления потенциала соответствует времени растворения пассивирующего слоя. [45]
Страницы: 1 2 3 4