Время - установление - адсорбционное равновесие
Cтраница 3
Структура пористого тела в значительной степени может вли ять на кинетику адсорбции. При адсорбции на пористых телах появляется стадия переноса вещества внутри пор, для которой характерен, главным образом, диффузионный механизм. Часто этв стадия определяет время установления адсорбционного равновесия. [31]
Структура пористого тела в значительной степени может влиять на кинетику адсорбции. При адсорбции на пористых челах появляется стадия переноса вещества внутри пор, для которой характерен, главным образом, диффузионный механизм. Часто эта стадия определяет время установления адсорбционного равновесия. [32]
Собирают прибор для титрования, состоящий из крутильных весов, штатива с тремя кюветами и ультратермостата. Включают ультратермостат и устанавливают температуру 40 С. Измерения проводят при повышенной температуре, чтобы уменьшить время установления адсорбционного равновесия. Буферный раствор создает среду с постоянной ионной силой и рН, что обеспечивает воспроизводимость результатов при определении поверхностного натяжения. [33]
Сведения о кинетике быстропротекающих процессов, например, скорости адсорбции и хемосорбции циклогексана на М, были получены при помощи масс-спектрометра с полевой ионизацией Если в источник с иглой, который служил реактором, впускать циклогексан при 20 С и р Ю - - Ю 5 тор, то при наложении поля с градиентом на игле Ю7 - I08 г / см, на ней не. При уменьшении напряженности поля или его выключении ионизация замедляется и проир-ходит адсорбция циклогексана на игле, поэтому при последуицем наложении поля он десорбируется и может быть фиксирован. Меняя продолжительность импульсов напряжения и промежуаок между ними, можно определить время установления адсорбционного равновесия, т.е. скорость адсорбции и хемосорбции; первая ( анализировался яогг с массой М s 84) оказалась равной 8 мсэк, а вторая ( с образованием радикала CgHjj с М 83) - 40 моек. [34]
Количество адсорбента на дне гильзы точно знать нет надобности, важно только, чтобы оно в 10 - 15 раз превышало количество адсорбента в чашечке весов. Тогда примеси распределяются - по поверхности всей массы адсорбента, и их количество, приходящееся на адсорбент в чашечке весов, снизится настолько, что уже не будет конкурировать с адсорбируемым веществом. Однако следует помнить, что такой прием увеличит время откачки адсорбента, а также может несколько растянуть время установления адсорбционного равновесия. [35]
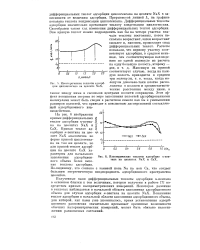 |
Изосторичоские теплоты адсорбции циклогекоапа на цеолите NaX.| Изостерические теплоты адсорбции н-пентана на цеолитах NaX и СаХ. [36] |
Полученные нами дифференциальные теплоты адсорбции н-пентана в основном близки к тем величинам, которые получены в работе [7] посредством прямых калориметрических измерений. Некоторое различие в теплотах наблюдается в начальной области заполнения адсорбционного объема для случая адсорбции к-пентана на цеолите NaX. Понижение теплот адсорбции в начальной области заполнения адсорбционного объема, для которой, как нами уже упоминалось, время установления адсорбционного равновесия значительно превышает временные возможности обычных калориметрических измерений, может быть обязано недостижению равновесных состояний. [37]
Процесс проникания молекул в микропоры существенно зависит от температуры и носит активированный характер. Таким образом, адсорбция как бы осложняется активированным характером диффузии. Это приводит к тому, что в определенных температурных условиях скорость адсорбции очень мала, и в экспериментальных исследованиях мы или вообще не фиксируем сколь-либо заметной адсорбируемости, или наблюдаем лишь частичное заполнение адсорбционного пространства. Наступает как бы псевдоравповесное состояние, наблюдаемое в опыте. При увеличении температуры скорость проникания молекул в объем микропор увеличивается, что приводит к уменьшению времени установления адсорбционного равновесия в пределе соответствующего обычным случаям адсорбции. [38]
Изучение токов ТСД в цеолите NaA показало, что максимумы при температурах около 200 и 230 К связаны с размораживанием катионов натрия. Адсорбция азота вызывает смещение этих максимумов в сторону низких температур. Величина смещения примерно пропорциональна количеству адсорбированного азота и составляет 5 К на молекулу для первого максимума и 2 - 3 К на молекулу для второго. Это смещение вызвано взаимодействием адсорбированных молекул азота с катионами. Температура начала десорбции азота совпадает с температурой появления максимумов тока термостимулированной деполяризации. Таким образом, адсорбированные молекулы азота и катионы приобретают подвижность в одной и той же области температур. Это примерно те же температуры, при которых, по данным А. М. Архарова, Б. П. Беринга, И. А. Калинниковой и В. В. Серпинского, для той же системы наблюдается резкое возрастание времени установления адсорбционного равновесия. Можно думать поэтому, что процессом, ограничивающим скорость внутрикристаллической диффузии при низких температурах, является ограниченная подвижность катионов, расположенных у входов в полости цеолита и взаимодействующих с адсорбируемыми молекулами. [39]
Страницы: 1 2 3