Всаливание
Cтраница 1
Всаливание, наблюдаемое для модельных амидов, оснований нуклеиновых кислот и полимеров проще всего объясняется прямым взаимодействием между диполями этих соединений и ионами, находящимися в растворителе, однако природа этих взаимодействий не вполне определенна и такое объяснение не строго обоснованно. Во всех этих случаях, по-видимому, большие и слабо сольватирован-ные ионы способны легко терять достаточное количество сольватной воды, чтобы эффективно взаимодействовать с зарядами или диполями с относительно слабым полем. Можно предположить, что молекула растворенного вещества находится в некоторой полости, образованной в растворителе. [1]
Всаливание перхлоратами, по-видимому, обусловлено большими энтропийными вкладами. Дй г имеют тенденцию к совпадению по знаку, что характерно вообще для большинства взаимодействий между растворителями и растворенными веществами ( принцип компенсации см. в гл. [2]
Всаливание при экстракции обусловлено повышением растворимости в воде. [3]
Всаливание называют также гидротропным растворением. Это явление объясняют влиянием всаливателей на структуру воды, на увеличение диэлектрической постоянной раствора, а также образованием малопрочных комплексных соединений органического вещества с введенным электролитом. [4]
 |
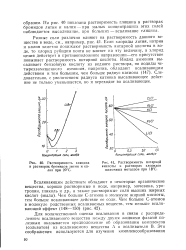
Коэффициенты распределения w - толуидина между хлороформом и водой. [5] |
Всаливание - явление противоположное высаливанию. Известны попытки связать высаливание и всализание с изменением коэффициента активности / вещества под влиянием солей. Однако не ясно, почему разные соли вызывают разные по знаку изменения f одного и того же вещества. Очевидно, здесь следует признать не столько изменение f, сколько специфичность влияния отдельных солей. Повышение растворимости вызывается взаимодействием между компонентами. Если образуется малопрочный комплекс, то возрастание растворимости незначительно. В этом случае Е Р0, поэтому константа всаливания представляет собою величину меньше нуля. [6]
Всаливание в фазу экстрагента приводит к увеличению коэффициента распределения. [7]
Поскольку всаливание гидрофобными ионами вызвано в первую очередь структурными эффектами, теория, рассчитанная на успех, должна, по-видимому, в большей степени опираться на статистическую термодинамику, чем на электростатику. Распространение этих теорий на растворы неэлектролитов, как это было сделано Немети и Шерагой [75], Пиеротти [76] или Бен-Наймом [78], может представлять интерес. [8]
Эффект всаливания заметно повышается, если в органической молекуле есть полярные группы [4]: бензол анилин фенол бензойная кислота фталевая кислота С салициловая кислота. Из этого следует, что между ониевым ионом и полярной группой в органической молекуле имеется ион-дипольное взаимодействие, которое увеличивает растворимость органических молекул. [9]
При всаливании адсорбируемость веществ на электроде понижается. [10]
Высаливание ( всаливание) рассматривается как результат изменения ближней гидратации высаливаемого иона в растворе под влиянием высаливателя. Показано, что основное значение имеет ориентация молекул воды вблизи высаливаемого иона и ее изменение под действием ионов высаливателя. Суммарный эффект зависит от того, какое из этих влияний преобладает. [11]
Высаливание ( всаливание) рассматривается как результат изменения ближней гидратации высаливаемого иона в растворе под влиянием высаливателя. Показано, что основное значение имеет ориентация молекул воды вблизи высаливаемого иона и ее изменение под действием ионов высаливателя. Суммарный эффект зависит от того, какое из этих влияний преобладает. [12]
По механизму всаливания, связанному с увеличением растворимости органического субстрата в водной фазе при добавлении катализатора межфазного переноса, реакция осуществляется в водной фазе. Этот механизм также включает три основные стадии. [13]
Для количественной оценки всаливания в связи с распределением осаливаемого вещества между двумя фазами наиболее полезным оказывается предположение об образовании комплексов ( или сольватов) из всаливаемого вещества А и всаливателя В. [14]
 |
Растворимость глицина в растворах бромидов лития и калия при 20 С.| Растворимость янтарной. [15] |
Страницы: 1 2 3 4