Всаливание
Cтраница 3
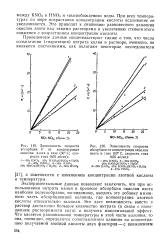 |
Зависимость скорости [ IMAGE ] Зависимость скорости. [31] |
При всех температурах по мере возрастания концентрации кислоты всаливание ее увеличивается. Это приводит к снижению равновесного давления окислов азота над такими растворами и увеличению степени этого снижения с возрастанием концентрации кислоты. [32]
Таким образом, можно сделать вывод, что всаливание, обусловленное органическими солями, вызывается главным образом непосредственным взаимодействием между солью и неэлектролитом, причем состояние последнего в таких системах близко к его состоянию в водно-органических растворителях. [33]
Денуайе, Пеллетье и Жоликер [224] показали, что такое всаливание связано с гидрофобной гидратацией вблизи этих солей. Растворимость неполярных электролитов в значительной степени лимитируется возрастанием энтропии, которое происходит вследствие упорядочения структуры воды при их растворении. Крупные гидрофобные ионы также вызывают упорядочение структуры воды. Обладая более упорядоченной структурой, чем чистая вода, растворы указанных солей требуют меньшей работы для растворения неэлектролита, вследствие чего растворимость последних возрастает. Растворение мылами и моющими средствами представляет предельные случаи всаливания. При этом образуется смешанная мицелла из неэлектролитов и органических ионов с длинной цепью. Рассмотренная Немети и Ше-рагой [75] гидрофобная связь и предположенное Диамондом [225] спаривание образующих структуру ионов также можно считать связанными с всаливанием. [34]
На вопрос, является ли образование ассоциированного комплекса необходимым для всаливания, можно получить ответ при изучении парциальных или кажущихся моляльных объемов гидрофобных солей. С другой стороны, Дезнойр и Арел [85] на основании изучения гомологов солей RNH3Br показали, что при допущении даль-нодействующих кулоновых сил jv уменьшается с концентрацией вплоть до критической концентрации мицеллы, но резко возрастает в процессе мицеллизации. Такое сильное увеличение объема было отнесено за счет появления свободного объема в мицелле между органическими ионами. Как было показано в разд. [35]
Это явление называют высаливанием, а противоположное ему по эффекту - всаливанием. [36]
Однако необходимо отметить, что переход органических молекул в водную фазу ( всаливание) может привести в конечном итоге к так называемому мицеллярному катализу вследствие образования мицелл под действием поверхностно-активных веществ и повышения концентрации реагирующих веществ внутри мицеллы. Эту возможность следует учитывать, поскольку многие ониевые соли являются поверхностно-активными веществами. В том случае, когда в молекуле ониевой соли имеется одна или две длинноцепочечные группы, мицеллообра-зование наступает довольно быстро. [37]
Однако имеются электролиты, с увеличением концентрации которых происходит увеличение растворимости газа - всаливание. Одновременно с изменением растворимости газа происходит изменение его коэффициента активности. При этом измеряемое значение Id на покрытом мембраной электроде, пропорциональное afC, изменяется в зависимости от того, какая из величин изменяется быстрее с изменением концентрации электролита - / или С. [38]
При экстракции с высаливанием из водного раствора коэффициент распределения вещества увеличивается, при всаливании - уменьшается. [39]
В случае высаливания из водного раствора коэффициент распределения данного вещества увеличивается, при всаливании уменьшается. [40]
В целом, если основываться на свойствах, таких, как кажущиеся моляльные количества и всаливание неэлектролитов ( разд. III), можно полагать, что Et4NBr усиливает структуру воды. Но если это так, то температурная зависимость ДГструкт, установленная по сдвигам частот, может включать не поддающийся объяснению эффект. [41]
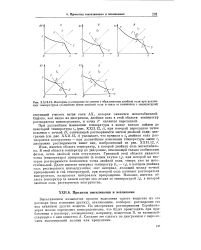 |
Изотермы растворимости систем с образованием двойной соли при различных температурах ( появление ветви двойной соли и связь ее изменения с температурой. [42] |
Высаливанием называется процесс выделения одного вещества из его раствора ( под влиянием других); всаливанием, наоборот, растворение его под влиянием других веществ. [43]
В настоящей работе приведен обзор современного состояния проблемы сольватации ионов и теорий, объясняющих эффекты высаливания и всаливания неэлектролитов солями; предпринята попытка обнаружить влияние этих эффектов на термодинамические свойства электролитов при ограниченной концентрации. Рассмотрены лишь те системы, в которых ионные ассоциации и другие виды ближнего взаимодействия между ионами невелики. В силу того что большая часть работ была проведена с водой, а не с другими растворителями, основное внимание в настоящем обзоре уделено водным растворам. [44]
Поскольку для неорганических электролитов вклады отдельных ионов в ks примерно аддитивны, то и вклады отдельных электролитов в эффекты всаливания в растворах смесей электролитов также аддитивны. [45]
Страницы: 1 2 3 4