Термодинамический вывод
Cтраница 1
Термодинамический вывод этих формул позволяет детализировать зависимость постоянной реакции от температуры, но элементарный кинетический вывод обладает преимуществом физической наглядности. Мы вернемся к рассмотрению закона действующих масс в статистической физике в § § 49, 50, в которых будут проанализированы две физические задачи - ионизация атомов и диссоциация молекул двухатомного газа. [1]
Термодинамический вывод основывается на законе Больцмана, согласно которому в состоянии равновесия отношение вероятности нахождения частиц в двух местах, характеризуемое отношением их числа пли отношением их концентраций в этих местах, должно быть равно отношению величин е kT, где и - потенциальная энергия частиц в рассматриваемых местах. [2]
Термодинамический вывод аналогичен выводу в теории Гиббса и может быть сделан следующим образом ( ср. [3]
Термодинамический вывод Дешмэна основан на известной формуле Клапейрона-Клау - зиуса, связывающей скрытую теплоту перехода какого-либо тела из одного состояния в другое с температурой, давлением и ходом зависимости давления насыщенного пара от температуры. Из промежуточных формул Дешмэна можно получить как вторую, так и первую формулу Ричардсона в зависимости от того, учитывать ли теплоемкость электронного газа внутри металла по методам квантовой или классической физики. [4]
Термодинамический вывод этих формул позволяет детализировать зависимость постоянной реакции от температуры, но элементарный кинетический вывод обладает преимуществом физической наглядности. Мы вернемся к рассмотрению закона действующих масс в статистической физике в § § 49, 50, в которых будут проанализированы две физические задачи - ионизация атомов и диссоциация молекул двухатомного газа. [5]
Термодинамический вывод основывается на принципе Больц-мана, согласно которому при равновесии отношение вероятностей того, что две частицы будут находиться в двух различных местах, равно отношению величин e - ufkT, где и - потенциальная энергия частицы в данном месте. [6]
Термодинамический вывод уравнения химического равновесия основан на следующих рассуждениях. [7]
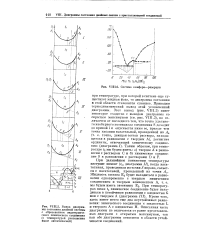 |
Вывод диаграммы состояния двойной системы с образованием эндотермического химического соединения ( с температурой разложения выше эвтектической.| Система камфора-резорцин. [8] |
Приводим термодинамический вывод этой усложненной диаграммы. [9]
Независимо от термодинамических выводов, которые можно сделать из рассмотрения фазовых диаграмм, основным фактором, контролирующим коррозию материала, является скорость диффузии в него коррозионной жидкости. Во многих случаях полностью избежать разрушения материала, по-видимому, невозможно; обычно анализ должен показать, что скорость растворения материала можно снизить до приемлемых значений. Эти значения различны для каждой системы и типа измерения. [10]
При использовании термодинамических выводов следует иметь в виду, что термодинамика рассматривает обратимые процессы в идеальных системах. [11]
В приведенном выше термодинамическом выводе с самого начала было сделано предположение о том, что кристалл огранен плоскими гранями, которые при отложении на кристалле вещества или удалении его с поверхности должны сохраняться. [12]
Здесь будет рассмотрен первоначальный термодинамический вывод уравнения Аррениуса, так как он позволяет понять сущность влияния температуры на скорость реакции. [13]
Здесь будет рассмотрен первоначальный термодинамический вывод уравнения Аррениуса, так как он хорошо позволяет понять сущность влияния температуры на скорость реакции. [14]
В основе всех термодинамических выводов лежат первый, второй и третий законы термодинамики. Эти законы не могут быть выведены и представляют собой умозаключения, обобщающие опыт, накопленный деятельностью человечества. [15]
Страницы: 1 2 3