Выделение - свободный иод
Cтраница 3
Метод основан на взаимодействии оксиэтилированных соединений с иодо-водородной кислотой с выделением свободного иода и последующем титровании иода стандартным раствором тиосульфата натрия в присутствии крахмала. [31]
Получающаяся смесь кислот HJ H2SO4 легко окисляется кислородом воздуха с выделением свободного иода и потому во избежание его потерь расход сернистого газа увеличивают до 170 - 250 % от теоретического. Концентрация получающейся смеси кислот ( 80 - 120 г / л HJ, 55 - 90 г / л H2S04) зависит от давления водяного пара в иодо-воздушной смеси. [32]
Окончание титрования устанавливают по появлению неисчезающего коричневого окрашивания, вызываемого выделением свободного иода. При этом анализируемый образец изолируют от атмосферной влаги. Стандартный раствор сохраняют в стеклянных сосудах небольшой емкости с притертыми пробками. [33]
Доказать с помощью раствора крахмала, что желтая окраска обусловлена выделением свободного иода. [34]
Иодид калия KJ окисляется солями меди ( II) с выделением свободного иода. [35]
Образующаяся соляная кислота реагирует со смесью KJ и KJO3 с выделением свободного иода. Последний определяют титрованием тиосульфатом. [36]
Йодистый водород в водном растворе окисляется постепенно на воздухе с выделением свободного иода. Способность йодистого водорода как восстановителя используется для количественного го определения. [37]
Пятивалентная сурьма при взаимодействии с иодидом вначале восстанавливается до трехвалентной с выделением свободного иода, а затем вступает в реакцию с образованием окрашенного комплекса. Выделившийся иод обесцвечивают сульфитом. [38]
Получающаяся смесь кислот HI и HjSO легко окисляется кислородом воздуха с выделением свободного иода и потому во избежание его потерь расход сернистого газа увеличивают до 170 - 250 % от теоретического. Концентрация получающейся смеси кислот ( 80 - 120 г / л HI, 55 - 90 г / л H2SO4) зависит от давления водяного пара в иодо-воздушной смеси. [39]
Получающаяся смесь кислот HI и H2SO4 легко окисляется кислородом воздуха с выделением свободного иода и потому во избежание его потерь расход сернистого газа увеличивают до 170 - 250 % от теоретического. Концентрация получающейся смеси кислот ( 80 - 120 - г / л HI, 55 - 90 г / л H2SO4) зависит от давления водяного пара в иодо-воздушной смеси. [40]
Ионы Fe3, Cu2 и Sby с I - взаимодействуют с выделением свободного иода, окрашивающего растворы в желтый или бурый цвет. [41]
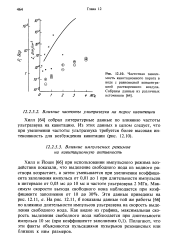 |
Частотная зависимость кавитационного порога в воде с равновесной концентрацией растворенного воздуха. Собраны данные из различных источников. [42] |
Хилл и Йоши [66] при использовании импульсного режима воздействия показали, что выделение свободного иода из водного раствора возрастает, а затем уменьшается при увеличении коэффициента заполнения импульса от 0 01 до 1 при длительности импульсов в интервале от 0 03 мс до 10 мс и частоте ультразвука 2 МГц. Эти данные приведены на рис. 12.11, а. На рис. 12.11, б показаны данные той же работы [66] по влиянию длительности импульсов ультразвука на скорость выделения свободного иода. Полагают, что эти факты объясняются пульсациями пузырьков резонансных или близких к ним размеров. [43]
В то время как ионы Fe3 и Си2 обычно восстанавливаются иодидом с выделением свободного иода, как ферро -, так и купро-комплексы EDTA окисляются иодом. [44]
Портнову и В. А. Скворцову [171], глицерин задерживает разложение иодовисмутита при стоянии с выделением свободного иода, но полностью но предотвращает его выделения. [45]
Страницы: 1 2 3 4