Выделение - натрий
Cтраница 1
Выделение натрия, происходящее при изменении состава электролита, приводит к разрушению угольной футеровки. Алюминий может взаимодействовать с углеродом и образовывать карбид алюминия, который способствует проникновению металла в трещины и поры катодных блоков, разрушая их. Для устранения разрушения угольной футеровки на последней организуют гарнисаж. [1]
Потенциалы выделения натрия выражены в вес. [2]
Процесс выделения натрия усиливает разрушение углеродистых материалов вследствие химического взаимодействия натрия с углеродом. Это и является основной причиной разрушения подины электролизера. [3]
Благодаря этому выделение натрия на ртути с образованием амальгамы происходит при потенциале на - 0 9 в более низком, чем оно происходило бы на твердом электроде, с которым натрий не взаимодействует. Такое понижение потенциала выделения называется иногда деполяризацией. В условиях электролиза на выделение водорода расходуется обычно менее 5 % тока. [4]
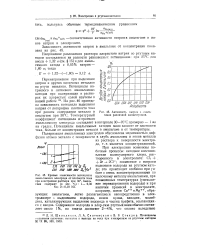 |
Активность натрия в амальгамах различной концентрации.| Кривые зависимости потенциала. [5] |
Перенапряжение при выделении натрия и других щелочных металлов на ртути невелико. На рис. 46 приведена зависимость потециала выделения натрия от логарифма плотности тока при разном содержании металла в амальгаме при 30 С. [6]
Кроме потребления тока и алюминия, процесс выделения натрия усиливает разрушение углеродистых материалов вследствие химического взаимодействия натрия с углеродом. [7]
Натрий в металлическом калии определяют весовым методом, основанным на выделении натрия в виде малорастворимой в спирте и избытке реактива-осадителя соли - натрийцинкуранилацетата. Этот метод обычно применяют для определения небольших количеств натрия. Высокое содержание калия в пробе мешает определению. Калий предварительно отделяют, осаждая его хлорной кислотой. [8]
Натрий в металлическом калии определяют весовым методом, основанным на выделении натрия в виде малорастворимой в спирте и избытке реактива-осадителя соли - натрийцинкуранилацетата. Этот метод обычно применяют для определения небольших количеств натрия. Высокое содержание калия в пробе мешает определению. Калий предварительно отделяют, осаждая его хлорной кислотой. [9]
Изучен 18 также вариант переработки бардяной золы, заключающийся в выделении натрия в виде фторида. После отделения смеси солей маточный раствор смешивают с раствором фторида калия, получаемого конверсией кремнефторида калия оборотным раствором поташа ( см. гл. При этом частично осаждается фторид натрия. Фильтрат подвергают вторичной выпарке для полного отделения оставшегося в растворе фторида натрия. Дальнейшей задачей является кристаллизация поташа; для этого осуществляют третью ступень выпарки. [10]
 |
Схема производства поташа из бардяной золы. [11] |
Изучен 10 также вариант переработки бардяной золы, заключающийся в выделении натрия в виде фторида. После отделения смеси солей маточный раствор смешивают с раствором фторида калия, получаемого конверсией кремнефторида калия оборотным раствором поташа ( см. гл. [12]
Характерным примером значительного облегчения процесса, связанного с материалом катода, является выделение натрия на ртути с образованием амальгамы. При этом потенциал выделения натрия из нейтрального раствора смещается в сторону электроположительных значений примерно на 1 В. [13]
Термодинамические расчеты показывают, что во всем интервале наиболее рациональных режимов борирования потенциалы выделения натрия ( напряжение разложения Na2O) больше, чем бора ( напряжение разложения В2О3), поэтому на катоде будет происходить предпочтительное выделение бора. Теоретически и экспериментально показано [205], что с увеличением доли ионов бора в расплаве разность потенциалов выделения натрия и бора возрастает, что равносильно уменьшению потенциала выделения бора и повышению потенциала выделения натрия. Увеличение доли ионов бора в расплаве ведет к ускорению роста глубины диффузионного слоя, а увеличение доли ионов натрия вызывает обратный эффект. [14]
К недостаткам способа следует отнести сравнительно более высокий расход электрической энергии ( потенциал выделения натрия на ртути выше, чем водорода на железе) и значительное содержание водорода в хлоре, что создает опасность взрывов. [15]
Страницы: 1 2 3 4