Выделение - полоний
Cтраница 3
Вполне очевидно, что существующие ныне соверше ные методы получения и выделения полония стали вс можны лишь после досконального изучения этого редк го радиоактивного металла. И его соединений, разум ется. [31]
Зив и Синицына Is - 21 ] показали, что процесс выделения полония на золоте и платине является обратимым и не зависит от количества полония, находящегося на электроде. На основании этих результатов и многочисленных экспериментальных данных других авторов [16 17 33-35] Зивом и Синицыной [8] было предложено объяснение причины применимости в ряде случаев закона Нернста в условиях неполного покрытия электрода осаждающимся веществом. По их мнению, условию для соблюдения сокращенной формы уравнения Нернста агеа1 отвечает не только случай полного покрытия электрода слоем осаждающегося вещества, но и тот случай, когда осаждающийся в микроколичествах металл не способен образовать твердого раствора или химического соединения с материалом электрода или когда Еа Ег. Тогда осаждение элемента может происходить лишь на сравнительно редко встречающихся на поверхности электрода центрах кристаллизации. При этом могут образовываться отдельные островки - агрегаты осаждающегося вещества, на которых продолжают осаждаться его атомы. Таким образом, эти агрегаты играют роль микроэлектродов, образующих самостоятельную фазу. В этом случае сокращенное уравнение Нернста должно быть применимым так же, как и для случая макросистем. При этом, как правило, наблюдается сдвиг потенциала выделения в сторону более положительных его значений ( недонапряжение) и влияние концентрации иона на этот потенциал уменьшается, а при очень больших значениях энергии сродства выделяющегося атома с электродом это влияние может исчезнуть совершенно. Таким образом, наличие отчетливого недонапряжения при электровыделении очень малых ( индикаторных) количеств вещества может быть использовано по крайней мере для качественного описания характера соответствующей бинарной системы: материал электрода-выделяющееся вещество. Экспериментальные данные, полученные авторами совместно с Кокоревым [46], подтверждают эту точку зрения. [32]
Авторы объясняют это различие тем обстоятельством, что в первом случае скорость выделения полония уменьшается вследствие уменьшения в ходе опыта концентрации полония в растворе. [33]
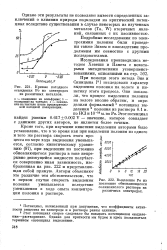
Находясь в ионодисперсном состоянии, полоний легко выделяется на меди, причем в кислой среде выделение полония увеличивается с повышением его концентрации; в слабощелочной среде выделение полония не зависит от концентрации и выражается прямой линией ( рис. 46 и 47), так как при рН от 8 до 9 полоний переходит в нерастворимое состояние. [35]
Тамман и Вильсон [6] в недавней работе изучили влияние природы и состояния изолированных электродов па скорость выделения полония. Не все активные ионы, сталкивающиеся с электродом, осаждаются на нем, и для каждого металла можно вычислить долю соударений, благоприятных для осаждения. Между этой долей благоприятных соударений и потенциалом электрода, по-видимому, пет отчетливой связи: здесь влияет лишь природа и состояние поверхности. Выделение па благородных металлах, таких, как золото и платина, всегда слабо и обусловлено явлением адсорбции. [36]
 |
Кривые катодного.| Выделение Ро из. [37] |
Кроме того, при изучении кинетики выделения авторами было установлено, что в то время как при выделении полония из одного и того же раствора скорость этого про - § цесса по мере хода выделения уменьшается, согласно кинетическому уравнению ( 87), при выделении из постоянно обновляющегося раствора в токе непрерывно движущейся жидкости полу ает-ся совершенно иная зависимость, изображенная на рис. 222 и представляющая собой прямую. Авторы объясняют это различие тем обстоятельством, что в первом случае скорость выделения полония уменьшается вследствие уменьшения в ходе опыта концентрации полония в растворе. [38]
В этот вопрос была внесена ясность благодаря работе Д. М. Зива и Г. С. Синицыной [1 ], которые показали, что процесс выделения полония на золоте обратим и величина потенциала не зависит от количества полония, находящегося на электроде. Как полагают авторы, при электролизе очень разбавленных растворов металл осаждается на подложке на редких центрах кристаллизации в виде отдельных агрегатов, а не равномерно по всей поверхности подложки. Эти агрегаты, образующие самостоятельную фазу, играют роль микроэлектродов. [39]
Обычно валентные состояния полония изучают с помощью изоморфной сокристаллизации полония с различными соединениями теллура, а также электрохимически, определяя критический потенциал выделения полония при различных его концентрациях в растворе. Качественные данные об изменении валентности полония при действии на него окислителей и восстановителей могут быть получены с помощью быстрого соосаждения полония с ( NH TeCle, а также с помощью экстракции полония различными органическими растворителями. В этом случае изменение коэффициента распределения может иллюстрировать изменение валентного состояния полония под действием различных агентов. [40]
Находясь в ионодисперсном состоянии, полоний легко выделяется на меди, причем в кислой среде выделение полония увеличивается с повышением его концентрации; в слабощелочной среде выделение полония не зависит от концентрации и выражается прямой линией ( рис. 46 и 47), так как при рН от 8 до 9 полоний переходит в нерастворимое состояние. [41]
Первое более или менее детальное изучение кинетики электрохимического выделения по методу Хевеши и Панета было произведено Жолио-Кюри [6], который с помощью предложенного им прибора произвел исследование процесса выделения полония на золотых электродах. [42]
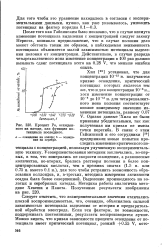 |
Процент Ро, осажденного на катоде, как функция потенциала последнего. [43] |
После того как Гайсинским было показано, что в случае висмута изменение потенциала выделения с концентрацией следует закону Нернста, возникло предположение, что в случае полония дело может обстоять таким же образом, а наблюдаемая неизменность потенциала объясняется малой зависимостью потенциала выделения полония от концентрации. [44]
Выделение полония из урановой смолки, содержащей - 0 1 мг полония на 1 т руды, является процессом чрезвычайно трудоемким. Другими несравнимо более удобными источниками получения полония могут служить старые соли радия, которые при равновесии содержат 0 2 мг полония на 1 г радия, а также активный осадок радона. [45]
Страницы: 1 2 3 4