Выделение - галлий
Cтраница 3
Швейцария), предназначен для выделения галлия и гадолиния из отходов, содержащих оба эти элемента в виде оксидов или соединений, переводимых в оксиды. [31]
Галлий из слабокислых растворов в условиях осаждения, описанных нами для других металлов, в отсутствие хлористого аммо-нвд количественно не осаждается. Присутствие NH Cl повышает степень выделения галлия, но все же не приводит к количественному осаждению. Исследование этого явления показало следующее. [32]
Бутилацетат имеет ряд недостатков, в частности большой расход вследствие осмоления и частичного омыления под действием сильнокислых растворов. Поэтому были предложены и другие экстрагенты для выделения галлия, в частности азот - и фосфорсодержащие. Желательно экстрагировать при меньшей кислотности, так как ее повышение повышает и извлечение примесей. Галлий из органической фазы ( бутил-ацетата, ТБФ) реэкстрагируют, промывая экстракт водой или 1 - 3 % - ным раствором щелочи. [33]
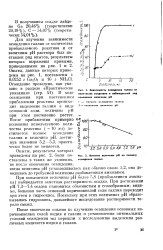 |
Зависимость осаждения галлия от количества осадителя и наблюдаемый ход изменения величины рН.| Влияние величины рН на полноту осаждения галлия. [34] |
Осаждение проведено, как указано в разделе Практические указания ( стр. В ходе осаждения при постепенном прибавлении реактива происходит выделение галлия в виде основной соли, величина рН при этом постепенно растет. [35]
При сливании растворов безводных этилендиамина и хлорида галлия в абсолютном метиловом спирте получены соединения хлорида галлия с одной, двумя и тремя молекулами этилендиамина. Экстракция последней соли хлороформом может быть использована как удобный метод выделения галлия ( см. гл. [36]
К сернокислому раствору, содержащему 0 05 - 0 2 г Ga ( нитрат-ион в очень небольших количествах не мешает), добавляют 50 мл концентрированного раствора аммиака, 10 - 40 г ( NH SO 6 г гидразинсульфата и разбавляют до 130 мл. При постоянной силе тока 5 а и напряжении - 3 3 - 4 в выделение галлия заканчивается в течение 30 - 60 мин. [37]
Выбор той или иной формы существенно зависит от сопутствующих элементов. Определение же галлия в минеральном сырье и во многих продуктах металлургического производства требует больших навесок, выделения галлия из сложной по составу смеси, что иногда бывает связано с потерей части галлия. Поэтому в таких случаях весовые методы применяются редко. [38]
Из полученных концентрированных галлатных растворов галлий выделяется электролизом. Примеси цинка, молибдена, а также органических веществ, попадающие в раствор из амальгамы, мешают выделению галлия. Цинк переходит в первые порции металла, которые прилипают к катоду, тогда как более чистый галлий стекает с катода. Молибден и органические вещества образуют черный налет на катоде и пассивируют его. В некоторых случаях перед электролизом для очистки раствора переосаждают галлий в виде гидроокиси с последующим растворением в едком натре. [39]
Для амперометрического определения галлия можно применять только реакции осаждения и комплексообразования, так как окислительно-восстановительные реакции для него, как известно, нехарактерны. К наименее растворимым соединениям галлия относится его ферроцианид, образованием которого воспользовался еще Лекок де Буабодран при выделении галлия из кислых растворов. Состав ферроцианида галлия установлен И. В. Тананае-вым и Н. В. Баусовой [1], разработавшими также амперометри-ческий метод определения по току окисления ферроцианида на платиновом электроде. Растворимость ферроцианида галлия очень мала - можно определять до 10 мкг галлия в 20 мл. Алюминий, который почти всегда сопутствует галлию в растворах, не мешает титрованию, хотя при относительно больших количествах алюминия ток окисления ферроцианида заметно понижается, вследствие чего определение конечной точки становится менее отчетливым. Влияние алюминия было замечено и при других титрованиях и может быть устранено титрованием с таким электродом сравнения, потенциал которого лишь не намного отличался бы от потенциала окисления ферроцианида, например с перманганатным электродом ( см. гл. [40]
Ферроцианиды играют довольно важную роль в аналитической химии галлия, индия и таллия. Ферроцианид галлия Ga4i [ Fe ( iCN) 6 ] 3 получил еще Лекок де Буабодран, пользовавшийся им для выделения галлия из кислых растворов: из 12 % - ной соляной кислоты осаждается примерно 0 1 мг галлия из 10 мл раствора. Подробное исследование реакции взаимодействия галлия с ферроцианидом, предпринятое И. В. Тананаевым и Н. В. Баусовой [1056] при помощи современных физико-химических методов анализа, показало, что при отношении ферроциа-нид: галлий не выше 0 75 образуется указанный выше простой ферроцианид. [41]
Так как основным источником галлия в настоящее время являются оборотные растворы алюминиевого производства, большое значение имеет отыскание таких способов выделения галлия из щелочных растворов, которые не изменяли бы их состав. К сожалению, рассматриваемые далее способы химического разделения основаны на осаждении не галлия, а алюминия. Поэтому они практически могут быть только методами концентрирования галлия. При электрохимических методах ( электролиз и цементация) из растворов выделяется галлий, однако для их успешного применения ( в особенности электролиза) необходима достаточно значительная концентрация галлия в растворе. [42]
Галлий - рассеянный элемент, в самородном состоянии не встречается и собственных руд не образует. Обычно примеси галлия встречаются в алюминиевых, железных и чаще всего цинковых рудах. Для выделения галлия используется сложная комплексная совокупность пирометаллурги-ческих, гидрометаллургических и электролитических методов. Галлий начинает сейчас все шире применяться в полупроводниковой промышленности, где используется его способность давать интерметаллические соединения с германием, кремнием, сурьмой, мышьяком и другими элементами. Добавка галлия в стеклянную массу позволяет получать стекла с высоким коэффициентом преломления световых лучей, а стекла на основе GasO3 хорошо пропускают инфракрасные лучи. Используют способность галлия к переохлаждению ( до - 40 С) и его высокую температуру кипения ( 2247 С) для изготовления термометров. [43]
При осаждении металла на одноименный твердый металл ( как и на жидкий) таких явлений не наблюдается. Однако все-таки имеются отличия в перенапряжении при осаждении на жидкий и твердый катоды. Так перенапряжение выделения галлия при низких плотностях тока на твердом галлии выше, чем на жидком, что связано с работой образования новой фазы. При повышенных плотностях тока, отвечающих перенапряжению более 0 1 В, поляризационные кривые на жидком и твердом галлии практически совпадают и имеют равные тафелевские наклоны. [44]
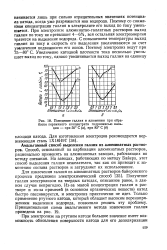 |
Поведение галлия и алюминия при обработке первичного концентрата гидроокисью кальция - при 50 С ( а, при 85 С ( 6. [45] |
Страницы: 1 2 3 4