Анодное выделение - кислород
Cтраница 1
Анодное выделение кислорода не сопровождается какими-либо другими электрохимическими процессами, и весь ток в пределах ошибки опыта расходуется только на выделение кислорода. [1]
Анодное выделение кислорода и оксида углерода ( IV), растворение и гидролиз хлора, образование хлората натрия проходят тем интенсивнее, чем выше рН анолита. Постоянство рН возникает в результате динамического равновесия между процессами, повышающими кислотность ( упомянутые побочные реакции), и процессом проникновения ионов гидроксила в результате электролитического переноса из катодной зоны в анодную. [2]
Анодное выделение кислорода в зависимости от условий пр-текания электролиза ( величина рН и материал анода) может протекать и в результате разряда молекул воды в кислых электролитах, и в результате разряда ионов гидроксила в щелочных электролитах. По-видимому, разряд молекул воды и ионов гидроксила при промежуточных значениях рН происходит независимо, по характерным для этих процессов закономерностям, однако протекание каждого из этих процессов связано с изменением состояния поверхности анода, что, в свою очередь, может оказывать влияние на протекание другого сопутствующего процесса. [3]
Заметное анодное выделение кислорода ( i 10 - 6 а-см 2) происходит только при весьма больших перенапряжениях, порядка 0 3 - 0 4 в. Подобные наблюдения были сделаны для большого числа металлов рядом исследователей З 164 406 - 41 которые часто измеряли только наименьшее перенапряжение при начинающемся видимом образовании пузырьков. Такое большое перенапряжение обусловливает трудность установления обратимого кислородного потенциала. Зависимость потенциала от плотности тока отвечает тафелевскому уравнению. Это соотношение для широкого интервала плотностей тока установили еще Вестхауер 14 на платине, иридии и родии и Бенневитц 233, но подробно исследовали только Боуден 15 и Хор 368 для платины. Хотя перенапряжение кислорода было предметом детальных исследований, механизм реакций все еще не выяснен. [4]
 |
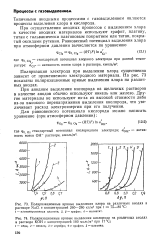
Зависимость напряжения на электролизере и отдельных его составляющих от плотности тока. [5] |
Механизм анодного выделения кислорода более сложен и менее изучен, чем механизм выделения водорода. Вероятным первичным процессом здесь является: в кислом растворе - разряд молекул воды: Н2О - е - Н - f - ОН, в щелочном - разряд ионов гидроксила: ОН - - е - ОН. [6]
 |
Поляризационные кри-вые при выделении хлора. [7] |
При анодном выделении кислорода всегда имеет место окисление поверхности анода с образованием поверхностных окислов. Из-за образования поверхностных окислов перенапряжение выделения кислорода в течение некоторого времени после начала электролиза повышается, пока не достигнет постоянного значения. На величину кислородного перенапряжения оказывают влияние присутствующие в растворе посторонние катионы, а также ионы фтора, которые увеличивают перенапряжение. [8]
При анодном выделении кислорода из щелочных растворов в качестве анодов обычно используют никель или железо. Другие материалы не используют из-за их высокой стоимости либо из-за высокого перенапряжения выделения кислорода, что увеличивает расход электроэнергии при его получении. [10]
При анодном выделении кислорода всегда имеет место окисление поверхности анода с образованием поверхностных оксидов. Из-за образования поверхностных оксидов перенапряжение выделения кислорода в течение некоторого времени после начала электролиза повышается, пока не достигнет постоянного значения. На величину кислородного перенапряжения оказывают влияние присутствующие в растворе посторонние катионы, а также ионы фтора, которые увеличивают перенапряжение. [11]
Так, анодное выделение кислорода возможно только тогда, когда электроны, освобождающиеся при реакции 2Н20 - 4Н 02 4е -, могут проходить через пассивирующий слой и приниматься металлом. Через пассивирующие слои на алюминии, висмуте, ниобии, тантале, титане и церии, исследованные Гюнтер-шульце и Бетц82, а также Вермилья 83 - 86, электроны переноситься не могут. Поэтому на этих металлах кислород выделяться не может даже при перенапряжениях порядка 100 б, так что в этих случаях ток практически полностью расходуется на образование слоя. [12]
Для реакции анодного выделения кислорода возникает тот же вопрос о природе медленной стадии, что и для катодного выделения водорода. Добавки некоторых органических веществ, например, тиомочевиньт, роданистого калия, резко повышают анодное перенапряжение на платине. Таким образом, и в этом случае значительная часть перенапряжения должна быть связана с электрохимической стадией разряда, предшествующей появлению адсорбированного кислорода на поверхности электрода. [13]
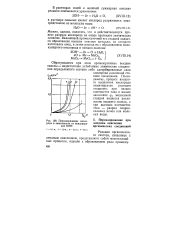 |
Перенапряжение кислорода в зависимости от концентрации КОН. [14] |
По-видимому, процесс анодного выделения кислорода лимитируется разными стадиями: при низких плотностях тока и малых значениях фа медленной стадией является разложение высшего окисла, а при высоких плотностях тока - разряд гидрок-сильных ионов или молекул воды. [15]
Страницы: 1 2 3 4