Заметное выделение - водород
Cтраница 2
Этот процесс начинается, как правило, при 9 1 и температуре около 0 С и ускоряется с повышением температуры. На Pd-пленке, однако, заметное выделение водорода наблюдается только при температуре выше 70 С, при более низкой температуре образовавшийся при распаде H2S водород адсорбируется на Pd. Количество водорода, определяемое в газовой фазе [233] после десорбции H2S на Ni - SiO2 при высокой температуре, меньше, чем должно быть согласно указанной схеме. Вероятно, из-за образования сульфидного слоя затрудняется диффузия водорода. [16]
Каспари [2] определил для ряда различных металлов потенциалы, при которых происходит видимое выделение водорода и кислорода соответственно на катодах и анодах. Величина потенциала, при котором происходит заметное выделение водорода или кислорода в виде пузырьков, не имеет какого-либо точного теоретического значения; она лишь близка к тому перенапряжению, при котором начинает итти заметный ток ( ср. Однако подобные данные имеют некоторый практический интерес в связи с вероятностью выделения водорода как одного из возможных процессов при электролитическом восстановлении и выделении металлов. Для того чтобы не смешивать перенапряжение, соответствующее началу выделения газа, и перенапряжение при определенной плотности тока, первое было названо минимальным перенапряжением. Однако прилагательное минимальное лишь вносит путаницу, так как выделение водорода возможно и при более низких перенапряжениях; поэтому ниже будет употребляться термин перенапряжение, соответствующее началу выделения пузырьков газа, так как он дает более точное описание того, что измеряется. [17]
Ток обмена при электроосаждении РЬ2 достаточно велик, и электрохимическая поляризация мала; в то же время перенапряжение водорода на свинцовом катоде весьма велико. Все это дает возможность вести осаждение свинца без сколько-нибудь заметного выделения водорода. Аналогичная картина наблюдается и для анодного процесса. Равновесный потенциал свинца настолько отрицательнее равновесного потенциала процесса разряда молекул воды, что выделение кислорода на свинцовом аноде ожидать не приходится. [18]
Если раствор кислый, то теоретически возможен разряд ионов водорода, так как стандартный потенциал водорода равен нулю. Однако из-за высокого перенапряжения водорода как на свинце, так и на олове заметного выделения водорода в этом случае не происходит. [19]
При более высоких плотностях тока выход палладия заметно уменьшается в результате совместного выделения водорода. Сопоставление этих данных с поляризационными кривыми ( см. рис. 83) показывает, что заметное выделение водорода происходит уже при потенциалах 0 25 - 0 3 в. По-видимому, в процессе электролиза происходит понижение рН раствора, что делает возможным выделение водорода при этих потенциалах. Поскольку изменение кислотности раствора влияет на стабильность комплексной соли [ Pd ( NH3) J C12, то можно предположить, что при уменьшении рН в приэлектродном слое создаются условия, способствующие образованию на поверхности электрода пленки из трудно растворимых солей палладия. [20]
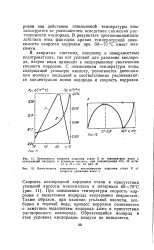 |
Качественная зависимость интенсивности коррозии стали К от скорости движения воды v. [21] |
При повышении температуры скорость коррозии с выделением водорода непрерывно возрастает. Таким образом, при наличии угольной кислоты, особенно в горячей воде, процесс коррозии развивается с заметным выделением водорода даже в присутствии растворенного кислорода. Образующийся водород в этих условиях кислородом воздуха не окисляется. [22]
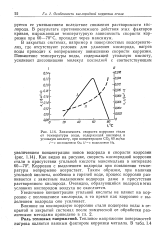 |
Зависимость скорости коррозии стали. [23] |
Коррозия с выделением водорода при повышении температуры непрерывно возрастает. Таким образом, при наличии угольной кислоты, особенно в горячей воде, процесс коррозии развивается с заметным выделением водорода даже в присутствии растворенного кислорода. Очевидно, образующийся водород в этих условиях кислородом воздуха не окисляется. [24]
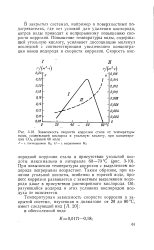 |
Зависимость скорости коррозии стали от температуры воды, содержащей кислород и угольную кислоту, при концентрации С02, равной 60 мг / кг. [25] |
При повышении температуры коррозия с выделением водорода непрерывно возрастает. Таким образом, при наличии угольной кислоты, особенно в горячей воде, процесс коррозии развивается с заметным выделением водорода даже в присутствии растворенного кислорода. Образующийся водород в этих условиях кислородом воздуха не окисляется. [26]
Для палладирования разработаны нитритные и фосфатные электролиты. Применяя фосфатные электролиты и устанавливая режим осаждения металла, исходят из того, чтобы на катоде не было заметного выделения водорода, при котором покрытия образуются темными и часто порошкообразными. [27]
Для выделения водорода на ртути необходима, следовательно, значительная поляризация катода. Так, например, из нейтрального раствора, в котором обратимый потенциал водорода равен - 0 415 в, сколько-нибудь заметное выделение водорода возможно лишь при потенциале катода около 1 26 в. Вследствие этого ион Na, для которого равно-весный потенциал в нормальном растворе его соли равен - 2 7 в, разряжается в заметных количествах уже при потенциале ртутного катода, равном - 1 2 в. Фактически выделение водорода при электролизе хлористых натрия и калия происходит не из нейтрального раствора, а из слабощелочного, образующегося в непосредственной близости от катода уже в первые моменты электролиза. Поэтому потенциал разряда водорода становится еще более отрицательным. [28]
Несмотря на некоторую деполяризацию, действие блескообразователей сопряжено с выделением водорода на катоде. Многие опыты явно показали, что блестящие покрытия олова возникают в тех пределах плотностей тока, при которых наряду с осаждением олова начинается заметное выделение водорода. Для изучения этого параллелизма был проведен ряд измерений катодной поляризации при прибавлении в кислый электролит SnS04 разных количеств блескообразователей, взятых в отдельности. Эти измерения показали, что некоторые блескообразователи, как, например, формалин и камфора, не проявляют заметного действия на катодную поляризацию олова. [29]
При соприкосновении поверхности стали с водой окисная пленка в зависимости от состава среды частично или полностью разрушается, что связано с ее разбуханием или же с электрохимическим восстановлением. Наличие в воде СО2 способствует этому восстановлению окислов железа, так как в ее присутствии, как было сказано, коррозия идет с заметным выделением водорода. Образующаяся же рыхлая ржавчина сравнительно легко уносится потоком воды. В случае действия натрий-катионированной воды слой ржавчины более прочен, так как он формируется при отсутствии выделения водорода. Вследствие этого транспортируемый к поверхности металла кислород ассимилируется металлом в воде с кислой реакцией более эффективно, чем в натрий-катионированной и в других нейтральных водах. [30]
Страницы: 1 2 3 4