Заметное выделение - водород
Cтраница 3
Загрязнения, действующие только на отрицательные пластины. Эти загрязнения включают металлы ( табл. 3 - 14), которые быстро выделяются в металлическом состоянии и вызывают значительное газообразование, а также химические соединения, которые восстанавливаются у отрицательной пластины более медленно и сказываются в небольшом, едва заметном выделении водорода. Между свинцом пластины и загрязнением, отложившимся на ней, образуется короткозамкнутая цепь. Свинцовый сульфат образуется в количестве, пропорциональном протекшему электричеству, причем вес пластины увеличивается. Водород выделяется на поверхности металлических загрязнений. Потенциал, требующийся для выделения водорода на различных металлах, различен, но он обыкновенно превосходит потенциал обратимого водородного электрода. Этот избыток потенциала объясняется перенапряжением. Водород легче выделяется на металлах, имеющих низкое перенапряжение, таких, как платина и другие металлы платиновой группы; поэтому эти металлы наиболее вредны для аккумуляторов. Медь и олово, имеющие более высокое перенапряжение, менее вредны. Металлы, перенапряжение для которых выше, чем разрядный потенциал водорода на свинце, такие, как кадмий, цинк и ртуть, производят или малое действие на отрицательную пластину, или вовсе его не производят. В некоторых случаях выделение водорода приводит к образованию других химических соединений. [31]
Благодаря образованию сплава электродный потенциал смещается на величину AGaM / ( ДОам - изобарно-изотермический потенциал образования амальгамы, Дж / моль М ( F - постоянная Фарадея, Кл-моль -) и становится в случае электролиза раствора хлорида натрия почти на 1 В положительнее потенциала выделения металлического натрия. Наряду с выделением щелочного металла, образующего амальгаму, на ртутном катоде возможно выделение водорода, равновесный потенциал которого много положительнее стационарного потенциала амальгамного электрода. Однако заметному выделению водорода на ртутном катоде препятствует высокое перенапряжение этой реакции на ртути. [32]
Постепенное окрашивание ( GeH в коричневый цвет наблюдается при быстром нагревании в глубоком вакууме. При 200 С наблюдается заметное выделение водорода и германия, а при 300 СС образуется чистый германий черного цвета. [33]
При очень высокой скорости электроосаждения цинка процесс определяется скоростью диффузии ионов цинка к поверхности катода и в таком случае описывается уравнением нестационарной диффузии. В этих условиях выделение металла в форме плотных осадков на катоде сменяется образованием порошкообразного цинка. Осаждение цинка в виде порошка осложняется заметным выделением водорода. Пузырьки его частично экранируют поверхность электрода и, отрываясь в дальнейшем от электрода, способствуют перемешиванию электролита. Вследствие обильного выделения водорода защелачивается прикатодное пространство и образуются коллоидные гидроокиси или основные соли цинка. Все это из-за обеднения прикатодного слоя разряжающимися ионами металла приводит к образованию наростов и дендритов цинка. Активная поверхность катода из-за образования на нем такого осадка быстро растет. [34]
Стеклянную трубку, на конце которой оттянут капилляр, для удобства работы рекомендуется соответствующим образом изгибать в зависимости от размеров микроскопа и применяемого увеличения. При выборе электролита для измерений электрохимических характеристик на металле, представляющем собой неполностью заполяризованную систему, руководствуются следующими общими соображениями [297, 298]: раствор должен вызывать процесс коррозии, но обладать достаточным омическим сопротивлением для четкого разграничения значения отдельных структурных составляющих. Кроме того, раствор не должен вызывать заметного выделения водорода и интенсивного образования продуктов коррозии во избежание попадания последних в капилляр микрощупа. [35]
Анодный процесс в элементе отличается некоторыми особенностями. Скорость коррозии магния в нейтральных растворах солей, где его поверхность покрыта окисной пленкой, в отсутствие поляризации электрода относительно невелика. Однако в тех же растворах при анодной поляризации растворение магния сопровождается заметным выделением водорода, скорость образования которого возрастает вместе с повышением плотности тока. [36]
Метансульфокислота и ее производные. Метансульфокислота получена несколькими путями, не включенными в вышеприведенное описание общих методов приготовления. Восстановление трихлорметансульфокислоты [53] электролитическим путем, а также действием амальгамы натрия или цинка происходит легко не сопровождаясь заметным выделением водорода, прежде чем реакция почти полностью не закончится. [37]
Коррозионное разрушение железа в щелочном растворе приводит к образованию Fe ( OH) 2 и водорода. Малорастворимая Fe ( OH) 2, отлагаясь на поверхности металла, образует пленку, которая тормозит дальнейшую реакцию, вследствие чего водорода образуется очень немного. Если же со щелочью взаимодействует порошкообразное железо, обладающее развитой поверхностью, то уже при обычной температуре наблюдается заметное выделение водорода. [38]
Коррозионное разрушение железа в щелочном растворе приводит к образованию Fe ( OH) 2 и водорода. Малорастворимая Fe ( OH) 2, отлагаясь на поверхности металла, образует пленку, которая тормозит дальнейшую реакцию, вследствие чего водорода образуется очень немного. Если же со щелочью взаимодействует порошкообразное железо, обладающее развитой поверхностью, то уже при обычной температуре наблюдается заметное выделение водорода. Количество образующегося в этих условиях водорода эквивалентно количеству прореагировавшего железа. [39]
Коррозию металлов в воде и водных растворах солей, рН которых находится в интервале 5 - 9, мы условно будем считать процессом, протекающим в нейтральной среде. На практике коррозия металлов происходит очень часто в таких нейтральных средах-в дождевой, речной, грунтовой, морской воде, в растворах солей, используемых в технике. Процесс коррозии большинства металлов в этих средах протекает почти исключительно с участием кислорода в катодной реакции и не сопровождается заметным выделением водорода. Продукты коррозии металлов обычно представляют собой малорастворимые вещества, например гидроокиси железа ( ржавчина), основные карбонаты цинка, свинца и меди, гидроокись алюминия и др. Такие вещества частично экранируют поверхность металла ( например, блокируя катодные участки), в какой-то мере защищая его от дальнейшей коррозии. Однако защитное действие продуктов коррозии черных и многих цветных металлов весьма невелико. Во влажной атмосфере гигроскопичные продукты коррозии не только не защищают металл, но даже способствуют его усиленному разрушению. Поэтому применение ингибиторов коррозии в нейтральных средах является одним из эффективных средств сохранения металла. [40]
Метансульфокислота и ее производные. Метансульфокислота получена несколькими путями, не включенными в вышеприведенное описание общих методов приготовления. Восстановление трихлорметан сульфокислоты [53] электролитическим путем, а также действием амальгамы натрия или цинка происходит легко, не сопровождаясь заметным выделением водорода, прежде чем реакция почти полностью не закончится. [41]
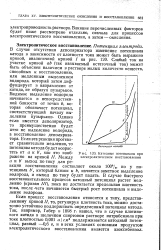 |
Катодные потенциалы при электролитическом восстановлении. [42] |
Видимое выделение водорода начинается в непосредственной близости от точки Ь, которая обозначает потенциал, соответствующий началу выделения пузырьков. Однако если имеется деполяризатор, то преимущественно будет итти не выделение водорода, а восстановление деполяризатора. Между а и Ь выход по току для реакции восстановления составляет около 100 %, но у потенциала Ь, который близок к Ь, начнется заметное выделение водорода, и выход по току будет падать. В случае быстрого восстановительного процесса катодный потенциал растет медленно ( кривая / / /), пока не достигается предельная плотность тока, после - чего начинается быстрый рост потенциала и выделение водорода. [43]
По краям электроды были впрессованы в полиэтилен. Смесь щелочи и этилового спирта проникала через поры запорных слоев, и спирт в рабочем слое Р дегидрировался с выделением водорода. Заметного выделения водорода на запорных слоях не происходило, ибо минимальное перенапряжение водорода на меди достаточно велико. [44]
Сказанное выше позволяет объяснить основные причины плохой воспроизводимости опытов. Прежде всего, получаемые результаты зависят от того, как к поверхности амальгамы подается раствор, содержащий примеси металла. Обычно при приливании раствора возникают случайные потоки, которые приводят в соприкосновение с поверхностью амальгамы различные слои раствора. Металлы, плохо смачиваемые ртутью и осаждающиеся на поверхности амальгамы с образованием островков заметного выделения водорода, стремятся к агрегации. Вследствие изменения поверхностного натяжения амальгамы, вызываемого разложением ее в зоне островков, поверхность их приподнята. Островки движутся по поверхности амальгамы, стремясь слиться воедино. Процесс слияния также характеризуется рядом случайностей, которые могут быть причиной различия результатов в одинаково поставленных опытах. [45]
Страницы: 1 2 3 4