Выражение - константа - скорость
Cтраница 2
При более строгом выводе в выражении константы скорости реакции (212.21) появляется дополнительный множитель х, так называемый трансмиссионный коэффициент, учитывающий возможность распада переходного состояния на молекулы исходных реагентов. В большинстве химических реакций х близок к единице. [16]
Константа равновесия характеризует состав и энергетическое состояние системы при данной температуре, а выражение константы скорости позволяет объяснить механизм достижения реакцией равновесного ( или другого) состояния. [17]
Так как все величины в правой части уравнения ( 38) могут быть измерены независимо друг от друга, то эта форма выражения константы скорости наиболее удобна для экспериментальной проверки теории. [18]
Вычислив по кинетической теории газов число ударов молекул СО2, приходящееся на единицу поверхности угля в единицу времени, и зная из опыта энергию активации Еа, они нашли выражение константы скорости, соответствующее классической теории столкновений. [19]
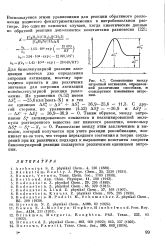 |
Соотношение между энтропией активации, определенной различными способами, и стандартным изменением энтропии. [20] |
Разногласие между этим заключением и выводом, который получается при учете реакции рекомбинации, возникает из-за того, что теория переходного состояния и теория соударений при их различных подходах к выражению константы скорости бимолекулярной реакции пользуются различными единицами энтропии. [21]
Положение о независимом протекании элементарных реакций вытекает из рассмотрения выражений для констант скорости, полученных методом теории соударений или методом активированного комплекса. Согласно этим выражениям константы скорости зависят только от параметров, характеризующих элементарный акт ( фактор соударений, стерический фактор, энергия активации в теории соударений, массы, моменты инерции, частоты колебаний исходных частиц и активированного комплекса в теории абсолютных скоростей реакций) и состояния среды ( температура, давление, состав), но не от процессов, одновременно идущих в этой среде. [22]
В выражении константы равновесия концентрации указаны л степенях, соо; нсмовукнци. Однако в выражениях констант скоростей прямой и обратной реакций показатели степени при концентрациях в общем случае не совпадают nj стехиометрическими коэффициентами. Это объясняется тем, что кинетические уравнения, выражающие зависимость скорости реакции от концентрации участвующих веществ, относятся или к самой медленной реакции, если процесс совершается через последовательные стадии, или к самой быстрой реакции, если процесс совершается н ICM параллельных стадий. [23]
 |
Зависимость константы скорости реакции гидрообессеривания различных кувейтских нефтяных остатков от их выхода ( на нефть. 1 - обычный катализатор. 2 - усовершенствованный катализатор. [24] |
Следующим шагом в выяснении математических зависимостей процесса обессеривания Галф является вывод уравнения, связывающего константу скорости реакции со свойствами исходного сырья. В идеальном случае это требовало бы выражения константы скорости реакции как некоторой функции таких свойств, как плотность остатка, содержание серы и пределы выкипания. К сожалению, имеющиеся данные недостаточны для вывода таких зависимостей. [25]
Как обычно, за стандартные принимают единичные значения концентраций. При этом условии произведение концентраций П ст входит в выражение константы скорости в качестве невидимого множителя размерности, зависящего от молекулярности реакции. [26]
Заметим, что в случае более тяжелых молекул с меньшим относительным различием масс изотопный эффект, обусловленный различием средних тепловых скоростей, меньше этой величины ( 1 4) и в предельном случае практически совпадающих приведенных масс отсутствует. Однако изотопный эффект не исчерпывается одним только различием предэкспоненциальных множителей з выражении констант скорости, но распространяется также на различие энергий активации реакций изотопных молекул, что дает значительно большие различия в скоростях этих реакций, особенно при-низких температурах. Согласно теории абсолютных скоростей ( см. гл. [27]
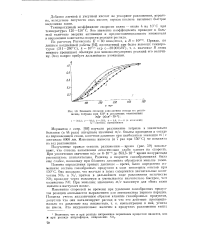 |
Влияние степени заполнения сосуда на разложение тетрила при 150 и различных отношениях m / v ( г / сж3 - 10 - 4. [28] |
Температурный коэффициент скорости велик - около 4 на 10 С при температурах 120 - 150 С. Это значение коэффициента приводит к большой величине энергии активации и предэкспоненциального множителя в выражении константы скорости реакции распада. [29]
Поскольку в результате потери шести вращательных степеней свободы происходит значительное понижение энтропии системы, приводящее к уменьшению предэк-споненциального множителя в выражении константы скорости, такого рода реакции в общем случае должны протекать медленнее, чем бимолекулярные реакции, имеющие ту же энергию активации. Это дает объяснение малых значений множителя Р, что уже отмечалось выше. [30]
Страницы: 1 2 3