Выражение - константа - скорость
Cтраница 3
Простая теория, предложенная Смолуховским, в которой молекулы рассматривают как сферические частицы, движущиеся в непрерывной жидкой среде, приводит к выражению константы скорости [ уравнение (1.3) ] через коэффициенты диффузии ( DA, /) в) и радиусы ( гА, гв) молекул. [31]
Возможность появления множителей, приводящих к компенсационным эффектам, вероятно, следует искать в суммарных выражениях констант скорости, а ее в константах скоростей элементарных стадий. Так, трактовку [392] фактически можно рассматривать как предположение о протекании реакции на неоднородной поверхности катализатора с экспоненциальным распределением по теплотам адсорбции при наличии соотношения линейности. Тогда в выражении константы скорости может появиться множитель с энергией активации в экспоненте, не зависящим от температуры. [32]
Все известные до сих пор масс-спектры индивидуальных веществ получены опытным путем. Затем происходит распад, константа скорости которого вычисляется по формул ам теории молекулярного распада. При подборе значений ЕМЯКС и эмпирического множителя частоты, входящего в выражение константы скорости мономолекулярного распада возбужденного иона, удалось получить удовлетворительное совпадение с опытом для случая бутена и низших сложных эфиров; при этом, однако, было показано, что теория неверна для низких энергий ионизирующих электронов, когда большая часть осколков образуется при прямой диссоциации электронным ударом. [33]
Соотношение теплот реакции передачи протона карбоний-ионом ( I) пропилену с образованием 4-метилпентена - 1 и 4-метилпентена - 2 такое же, как и при передаче протона катализатору. Реакции ( 3) и ( 4) приводят к одинаковым продуктам, и указать, какая из них реально протекает, затруднительно. Видимо, реакция ( 3) протекает с большей скоростью, так как эта реакция мономолекулярная, с высоким значением пред-экспоненты в выражении константы скорости, а реакция ( 4) - реакция второго порядка, и разница в энергиях активации их не должна быть большой. [34]
В главе II рассматриваются вопросы кинетики диссоциции двухатомных молекул в среде молекулярного газа. Характерная особенность кинетики диссоциации в молекулярных средах обусловлена процессами обмена колебательными квантами между реагирующими молекулами и частицами среды. В начале главы приведены данные о константах скорости обмена колебательными квантами, вычислена функция распределения колебательной энергии для квазистационарной стадии диссоциации и сформулировано выражение константы скорости диссоциации, зависящей от температур колебаний и поступательно-вращательного движения. Далее рассмотрена взаимосвязь процессов колебательной релаксации и диссоциации, проявляющаяся в сильных ударных волнах и при поглощении двухатомным газом ИК-излучения лазера. [35]
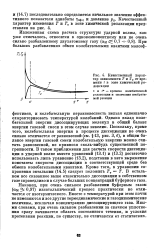 |
Качественный характер зависимости Т и Tv от времени t в зояе химической релаксации. [36] |
Однако вклад колебательной энергии диссоциирующих молекул в общий баланс энергии газовой смеси в этом случае невелик. Поскольку, кроме того, колебательная энергия в процессе диссоциации не очень сильно отличается от равновесной ( см. § 13, рис. 3, б), в общем балансе энергии газовой смеси колебательную энергию можно считать равновесной, не привнося сколь-нибудь существенной погрешности. В таком приближении для расчета скорости диссоциации в ударной волне вместо уравнений (13.1) и (13.2) достаточно использовать лишь уравнение (13.2), подставив в него выражение константы скорости диссоциации в соответствующей среде без обмена колебательными квантами. В остальном все сказанное выше относительно диссоциации в собственном газе справедливо и в случае больших концентраций буферного газа. Наконец, при очень сильном разбавлении буферным газом ( м 0 97) изэнтальпический процесс практически не отличается от изотермического. Вместе с температурой при этом почти не изменяются и все другие термодинамические и газодинамические величины, исключая концентрацию диссоциирующего газа. Иными словами, при очень сильном разбавлении за скачком уплотнения сразу начинается область постоянного течения, и условия протекания реакции, по существу, не отличаются от статических. [37]
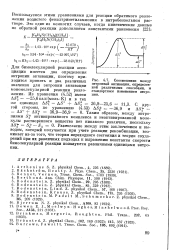 |
Соотношение между энтропией активации, определенной различными способами, и стандартным изменением энтропии. [38] |
Для бимолекулярной реакции ассоциации имеется два определения энтропии активации, поэтому приходится принять и два различных значения для энтропии активации мономолекулярной реакции разложения. Из уравнения (4.52) имеем AS - 25 6кал / ( моль - К) и в тех же единицах AS. Разногласие между этим заключением и выводом, который получается при учете реакции рекомбинации, возникает из-за того, что теория переходного состояния и теория соударений при их различных подходах к выражению константы скорости бимолекулярной реакции пользуются различными единицами энтропии. [39]
Авторы предлагают простые методы приближенной оценки величин констант равновесия образования активированного комплекса из экспериментальных значений констант скорости. В случае сложных кинетических зависимостей предполагается наличие некоторого эффективного равновесия образования активированных комплексов, константа этого равновесия также связана с константой скорости. Отсюда авторы вычисляют энтропию активированных комплексов некоторых реакций. При этом фактически предполагается, что в выражение константы скорости входят только множители, характеризующие скорость лимитирующей стадии. [40]
Следовательно, незамещенные ароматические галоидосоединения отличаются от жирных галоидосоединений большей энергией активации. В то время как независимые от температуры факторы констант скоростей для реакции обмана на одну и ту же группу в жирном и ароматическом ряду равны или близки, энергия активации для хлорбензола примерно на 20 ккал больше, чем у алифатического галоидосоединения. Введение активирующих групп SO3H, NOj снижает энергию активации. У 2 4-динитрохлорбензола энергии активации реакций уже близки к таковым у алифатических галоидосоединений. При этом реакции обмена галоида на алкокси - и оксигруппы и в жирном, и в ароматическом ряду принадлежат к реакциям нормального типа - не зависящий от температуры фактор PZ в выражении константы скорости реакции у них близок к числу столкновений реагирующих молекул, которое можно вычислить при помощи соответствующих уравнений кинетической теории газов. [41]
Страницы: 1 2 3