Вычисление - активность
Cтраница 2
Теория Дебая-Хюккеля [126, 127, 128, 247, 427] определяет теоретически соотношение между величинами коэфициентов активности и концентрацией в случае электролитов и позволяет вести вычисление активностей как функций плотности, знака заряда и валентности компонентов, присутствующих в реакционной жидкости. Характер растворителя отражается в формуле, он выражается диэлектрической постоянной и поведением отдельного иена, в ферме радиуса его электростатического действия. Таким образом обеспечивается возможность вычисления для данного примера катализа с помощью кислоты или основания всех изменений скорости, вызываемых изменениями в ионной среде и добавлением посторонних солей, или также благодаря изменению концентрации катализатора, являющегося кислотой или основанием. [16]
Как для отыскания свойств реальных газов следует обратиться к вычислению летучести, так в случае растворов центр тяжести переносится на вычисление активности. Нахождение связи между активностью, с одной стороны, и температурой, давлением и концентрацией, с другой, делает возможным применение термодинамических закономерностей к реальным растворам. [17]
Настоящая работа, являющаяся продолжением нашего первого сообщения [6], посвящена термодинамике смешанных растворов трех солей с общим ионом, подчиняющихся правилу Здановского, методам вычисления активности электролитов и растворимости солей и в смешанных растворах, а также влиянию индивидуальности ионов на аддитивность свойств растворов. [18]
В тех случаях, когда катализатор имеет форму, легко позволяющую вычислить его геометрическую поверхность, - например пластинка или проволока, - можно приближенно пользоваться при вычислении активности его геометрической поверхностью, хотя последняя вследствие микрошероховатости будет значительно меньше истинной. [19]
Вывод уравнений для вычисления активности ионов ОН в растворе слабого однокислотного основания в присутствии соли, содержащей одноименный с основанием катион, делается так же, как и при вычислении активности ионов Н в растворе слабой одноосновной кислоты в присутствии соли этой же кислоты ( см. стр. [20]
Вывод уравнений для вычисления активности ионов ОН - в растворе слабого однокислотного основания в присутствии соли, содержащей одноименный с основанием катион, делается так же, как и при вычислении активности ионов Н в растворе слабой одноосновной кислоты в присутствии соли этой же кислоты ( см. стр. [21]
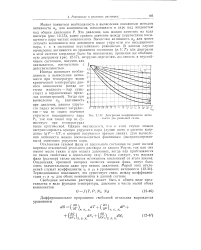 |
Диаграмма коэффициентов актив иости для реальных газов. [22] |
Это давление, как можно заметить из хода изотерм ( рис. 12 - 15), имеет среднее значение между упругостями насыщенного пара чистых компонентов. В данном случае вычисление активности из уравнения состояния ( р, V, Т) или диаграмм в этой системе координат было бы невозможно; применяя же обобщенную диаграмму ( рис. 12 - 17), нетрудно определить активность в неустойчивом состоянии, получив, как оказывается, соответствие с действительностью. [23]
Криометрические измерения показали что растворы AgNOs - KaSO4 идеальны, растворы AgNOs - КМОз мало отклоняются от идеальных, растворы AgNOs - LiCl ( ВаСЬ, КС1) имеют положительные или отрицательные отклонения. LiNOs криометрические кривые использованы наиболее полно с целью вычисления активностей, теплот и энтропии смешения. Интегральная теплота смешения приближается к Vs теплоты плавления, энтропия лишь незначительно отличается от соответствующей величины для идеальных растворов. [24]
В работе [5] нами предпринята попытка решения обратной задачи для этой системы. Из данных о фазовой диаграмме были вычислены коэффициенты активности воды и ТБФ в органической фазе ( способ вычисления активности экстрагента рассмотрен. Найдены также величины, пропорциональные коэффициентам активности дисольвата. Для определения параметров функции GE и значения К была составлена и решена методом наименьших квадратов система из 59 уравнений для коэффициентов активности всех трех компонентов органической фазы. При решении прямой задачи найденный таким путем набор параметров приводит к диаграмме, отличающейся от исходной, что обусловлено высокой чувствительностью диаграммы к неточностям в значениях параметров. Тем не менее, полученные данные позволяют сделать вывод о наличии в двойной системе ТБФ - U02 ( N03) 2 2 ТБФ отрицательных отклонений от идеальности. Найденная при решении обратной задачи величина К 236 ( стандартные состояния для ТБФ и и02 ( Ж) 3) 2 - 2ТБФ - чистые вещества, для U02 ( N03) 2 - гипотетический водный раствор со средней мо-ляльностью, равной единице) близка к значениям, определяемым другими способами. Задача согласования рассчитанной и опытной фазовой диаграмм для этой системы еще ждет своего решения. [25]
В качестве фильтра была применена ткань ФПП-15 и некоторые другие ее разновидности. К - Ляпидевский предложили производить вычисление активности изотопного состава продуктов распада радона, которая накапливалась иа фильтре к 5 - й, 10 - й, 20 - й, 30 - й, 40 - й и 50 - й минуте. По данным авторов, этот метод расчетов может быть использован при любом неравновесном состоянии коротко-живущих продуктов распада радона в воздухе. [26]
Ряд теоретических и экспериментальных исследований связан с распределением веществ между двумя фазами. В работах Н. А. Шилова и Л. К. Лепинь ( с 1920 г.), посвященных распределению вещества между двумя жидкостями, рекомендовано уравнение, частными случаями которого являются уравнения Гиббса-Дальтона и Нернста. Институт неорганической химии СО АН СССР; 1962 г.) предложил простой и удобный способ вычисления активности экстрагента в двухфазной области тройных систем вода-экстрагируемое вещество-нерастворимый в водной фазе экстрагент из данных по активности компонентов водной фазы и состава органической фазы вдоль линии расслаивания. [27]
Из предыдущего видно, что термодинамические свойства предельно разбавленных и идеальных растворов определяются только концентрацией. Результат этого взаимодействия формально равнозначен некоторому изменению концентрации веществ, что приводит к несовпадению свойств, рассчитанных по уравнениям Генри, Вант-Гоффа, Рауля, с фактически наблюдаемыми, Использование термодинамической активности вместо концентрации позволяет объединить все отклонения от идеального поведения и связать разные свойства растворов друг с другом на базе уравнений для идеальных и предельно разбавленных растворов, Но в таком случае важнейшей задачей термодинамики реальных растворов становится вычисление активности или коэффициента активности. [28]
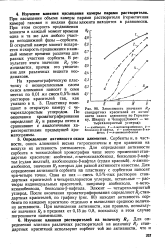 |
Зависимость значения Rf стандартных красителей от активности окиси алюминия по Германе-ку, Шварцу и Чекару ( Элюент - че-тыреххлор истый углерод. [29] |
Сорбенты и, в частности, окись алюминия весьма гигроскопичны и при хранении на воздухе их активность уменьшается. Для определения активности сорбента в тонкослойной хромографии чаще всего применяют стандартные красители: азобензол, n - метоксиазобензол, бензолазо - - наф-тол ( судан желтый), азобензолазо-р-нафтол ( судан красный), п-амино-азобензол, значения RJ которых для разной активности известны. Одна из них - смесь 0 5 % - ных растворов стандартных красителей в четыреххлористом углероде, остальные - растворы индивидуальных красителей, например азобензола, п-мето-ксиазобензола, бензолазо-р-нафтола. После окончания хроматографирования определяют Rf стандартных красителей, по графику ( рис. 80) находят активность сорбента по каждому красителю отдельно и вычисляют среднюю величину активности. При вычислении активности, как правило, используют значения Rf в пределах от 0 15 до 0 8, поскольку в этом случае погрешности наименьшие. [30]
Страницы: 1 2