Количественное вычисление
Cтраница 2
Можно предложить формальное теоретическое истолкование первичного солевого эффекта, хотя оно и мало пригодно для количественных вычислений. [16]
Это важно для понимания того факта, что истинную константу устойчивости можно использовать в случае количественного вычисления концентраций только для очень разбавленных растворов или для растворов с известными коэффициентами активности. Концентрационные константы можно использовать при вычислении концентраций веществ в растворе, но последние будут количественно верными только для тех условий, в которых была определена константа. Поэтому чаще всего эти константы используют при полуколичествепиом исследовании. [17]
В заключение следует отметить, что применение математических методов в анализе экономической перспективы позволяет доводить теоретические построения до количественных вычислений. [18]
Поэтому приведенный выше вид возможного взаимодействия нуклонов (131.11) более полезен для систематики возможных состояний нуклонов, нежели для количественных вычислений уровней или матрицы рассеяния. [19]
Однако наше представление о возникновении разнос: и потенциалов на границе двух жидкостей не ограничивается только качгстьенной стороной во многих случаях удается произвести количественное вычисление и проверив его нч опыте. Для этой цели возьмем два соприкасающих: я pacTBOja различной концентрации одного и того же электролита, cs - стоящего из двух одновалентных ионов Пусть число переноса положительного иона будет 1 - п, а отрицательного - ц Пропустим теперь количество электрлчества F от кониентриро энного раствора к разбавленному; то1 да 1 - п положительных грамм-ионов будут перенесены из концентрированного в разбавленный ра: твор и одновременно И отрицательных грамм-ионов - из разбавленного в концентрировчнный Обозначим через р концентрацию положительных и огрицательных ионов в концентрированном, а через р - в разбавленном растюре. [20]
Несмотря на то что из уравнения состояния Ван-дер - Ваальса можно сразу предсказать, каково будет отклонение от поведения идеального газа, все же оно недостаточно для точной оценки количественных вычислений. [21]
Известная приближенность теоретических расчетов химических сдвигов F19 и некоторая произвольность в выборе значений параметров ( в частности, полярности сигма-связи С - F) делают эти расчеты мало пригодными для количественных вычислений. С этой целью сопоставим уравнения Тафта (VII.7), (VII.8) с теоретическими уравнениями (VII.10) и ( VII. Основные выводы сводятся к следующему. [22]
Количественное вычисление энергии электронных состояний наталкивается на большие математические трудности. Для понимания многих особенностей электронных состоящий молекул прежде всего необходима их правильная классификация. [23]
Таким образом, качественные исследования закономерностей возрастания нелинейных восприимчивостей второго порядка с помощью измерения гиперполяризуемости растворов и нелинейных восприимчивостей порошков равнозначны. Для количественного вычисления нелинейных восприимчивостей необходимо исследование гиперпо-ляризуемостей, которые позволяют вычислить компоненты тензора нелинейной восприимчивости кристаллов по параметрам отдельных молекул. [24]
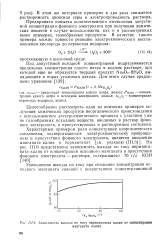 |
Зависимость выхода по току перманганата калия от концентрации. [25] |
В этом же интервале примерно в два раза снижается растворимость диоксида серы и электропроводность раствора. Предпринята попытка количественного вычисления допустимой концентрации фонового электролита при получении химических веществ в случае использования, как и в рассмотренных выше примерах, газообразных продуктов. [26]
 |
Диаграмма на плоскости. [27] |
С целью графического отображения водно-солевых систем используют линейные координаты с углами между ними в 60 или 90 для параметров концентраций и 90 для температуры. Выбор угла определяется удобством построений при количественных вычислениях. При построении изотермических проекций применяют нормирование по всем или некоторым компонентам, а также выражения в виде отношений концентраций отдельных ионов или отношения содержания воды к сумме солей. В некоторых случаях ( для пяти - и более компонентных систем) выбирают смешанный вариант построения плоских проекций - одна из них строится для основных выбранных компонентов ( обычно ионов этих компонентов), подвергнутых нормировке, а содержание остальных, оставшихся вне нормирующего полинома, выражают на проекциях как отношение к содержанию нормируемых ионов. [28]
Следующим важным свойством функции г з является то, что она позволяет не только устанавливать зависимость электронной плотности, а следовательно, и заряда от пространственных координат х, у и г, но позволяет вычислять результат и всякого другого измерения. Знание функции я э делает принципиально возможным количественное вычисление любого свойства в любой вещественной системе. Для перехода от одной задачи к другой необходимо лишь знание соответствующих операторов, которыми надо действовать на функцию перед интегрированием. Отсюда вытекает значение математической теории операторов в квантовой химии. [29]
Адсорбция метилового красного нестехиометрична относительно гидроксильных групп, поскольку его молекула очень объемиста. Следовательно, адсорбция метилового красного оказывается непригодной для количественного вычисления поверхностных силаноль-ных групп. [30]
Страницы: 1 2 3