F-актин
Cтраница 1
Структуру F-актина поддерживают гидрофобные взаимодействия, поэтому нейтральные соли и высокая температура повышают ее стабильность. Изменение объема при образовании F-актина из G-актина составляет 84 см3 на 1 моль G-актина. Столь большие величины Д1 / дают основание думать, что высокие давления должны сильно смещать равновесие в сторону образования G-актина. Так оно и есть в действительности. [1]
 |
Электронная микрофотография миофнбриллы мышцы лягушки.| Схема участка попереч - собой Двойную Спираль С О-субъ-ного сечения миофибриллы. единицами, повторяющимися че. [2] |
Тонкие нити F-актина о о о о о о о проходят через Z-диски. [3]
Спонтанная сборка филаментов F-актина - процесс, зависящий главным образом от гидрофобных взаимодействий между мономерами актина. Спонтанная сборка фила-ментов миознна - процесс, в основном определяемый образованием водородных связей между мономерами. Влияние давления на мышечные белки рассматриваются в работах Дрейцена, Кима и их сотрудников ( Ашег. [4]
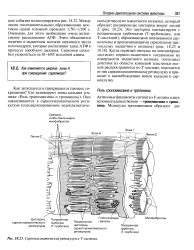 |
Саркоплазматический ретикулум и Т - система. [5] |
Актиновые филаменты состоят из F-актина и двух вспомогательных белков - тропомиозина и тропонина. [6]
Располагается в желобке между цепями F-актина. В покое тропомиозин закрывает в G-актине центры связывания с миозином. Длина молекулы тропомиозина равна семи глобулам G-актина. [7]
Актомиозин - комплекс миозина с F-актином - образуется в растворах при смешивании чистых фракций миозина и актина. Оказалось, что с нитями F-актина связываются только головы миозиновых молекул. При добавлении в раствор, содержащий актомиозиновые комплексы, молекул АТФ и ионов Mg - - - происходит диссоциация комплексов актомиозина. Головы миозиновых молекул отрываются от актиновых нитей. При этом происходит неконтролируемый гидролиз молекул АТФ. [8]
 |
Строение толстого миозинового филамента. [9] |
Актомиозин образуется при соединении миозина с F-актином. Ак-томиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной активностью, которая отличается от таковой миозина, АТФазная активность миозина значительно возрастает в присутствии стехиометрических количеств F-актина. Фермент актомиозин активируется ионами Mg2 и ингибируется этилендиаминтетраацетатом ( ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны. [10]
 |
Биохимический цикл мышечного сокращения. Объяснение в тексте. [11] |
АТФ обладает низким сродством к актину, и поэтому происходит отделение миозиновой ( АТФ) головки от F-актина. [12]
 |
Схема участка поперечного сечения миофибриллы. 1 - толстые нити, 2 - тонкие нити.| Схема продольного сечения миофибриллы при трех разных ее длинах.| Схема строения саркомера. [13] |
В саркомере число G-глобул равно примерно 800 на одну тонкую нить. Тонкие нити F-актина проходят через Z-диски. [14]
Переход G-актина в F-актин обусловлен ассоциацией нескольких глобулярных молекул в цепочку. [15]
Страницы: 1 2 3