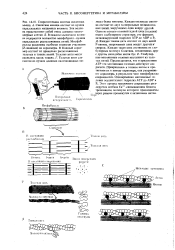
F-актин
Cтраница 2
Структуру F-актина поддерживают гидрофобные взаимодействия, поэтому нейтральные соли и высокая температура повышают ее стабильность. Изменение объема при образовании F-актина из G-актина составляет 84 см3 на 1 моль G-актина. Столь большие величины Д1 / дают основание думать, что высокие давления должны сильно смещать равновесие в сторону образования G-актина. Так оно и есть в действительности. [16]
Актомиозин - комплекс миозина с F-актином - образуется в растворах при смешивании чистых фракций миозина и актина. Оказалось, что с нитями F-актина связываются только головы миозиновых молекул. При добавлении в раствор, содержащий актомиозиновые комплексы, молекул АТФ и ионов Mg - - - происходит диссоциация комплексов актомиозина. Головы миозиновых молекул отрываются от актиновых нитей. При этом происходит неконтролируемый гидролиз молекул АТФ. [17]
Как видно из рис. 100, Б, сборка активного полимерного миозина из субъединиц ( состоящих в свою очередь из 5 полипептидных цепей) также чувствительна к давлению. В отличие от полимеризованного актина ( F-актина) полимер миозина стабилизирован главным образом полярными взаимодействиями. При образовании водородных связей объем возрастает примерно на 3 - 7 см3 / моль. В этом случае увеличение объема при сборке полимера будет достигать около 300 см3 / моль - столь большой величины, что высокие давления должны будут сильно благоприятствовать мономерному состоянию. Следовательно, нити миозина, образующиеся при большом давлении, должны быть короче обычного, что опять-таки наглядно подтверждается при прямом электронно-микроскопическом исследовании мышц придонных рыб. [18]
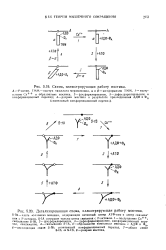 |
Схема, иллюстрирующая работу мостика.| Детализированная схема, иллюстрирующая работу мостика. [19] |
S-IA содержит только центр свявання с F-актином. [20]
 |
Микрофотографии волокна миозина ( а и коллагена ( б. [21] |
Актин хорошо растворим в воде, вязкость растворов небольшая. В присутствии солей полимеризуется, образуя полимер F-актин ( фибриллярный белок); при этом вязкость повышается. [22]
Каждая молекула миозина состоит из двух a - спиралъных полипептидных цепей, закрученных одна вокруг другой. Каждая тонкая нить состоит из двух цепей F-актина, закрученных одна вокруг другой в1 спираль. Каждая такая депь составлена из глобулярных молекул G-актина, соединенных друг с другом наподобие нитки бус. Глобулярные миозиновые головки выступают из толстых нитей. Предполагается, что в присутствии АТР эти миозиновые головки действуют как рычаги. Прикрепляясь к тонким нитям и притягивая их к центру саркомера, они укорачивают саркомеры, в результате чего миофибриллы сокращаются. [24]
Актомиозин образуется при соединении миозина с F-актином. Ак-томиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной активностью, которая отличается от таковой миозина, АТФазная активность миозина значительно возрастает в присутствии стехиометрических количеств F-актина. Фермент актомиозин активируется ионами Mg2 и ингибируется этилендиаминтетраацетатом ( ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны. [25]
Вирус табачной мозаики состоит из белковой оболочки и РНК. Цилиндрические конструкции из белков, найденные, например, в микротубулах [181], в хвостах фага Т4 [182] или в филаментах F-актина [183], часто описывают как спирали или линейные группы. Тем не менее следует помнить, что подобные агрегаты не содержат линейных цепей, таких, как, например, РНК, которая соединяет белковые субъединицы в вирусе табачной мозаики и образует особую спираль. Для описания таких моно - и полиспиральных образований используются различные способы. [26]
Актомиозин образуется при соединении миозина с F-актином. Ак-томиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной активностью, которая отличается от таковой миозина, АТФазная активность миозина значительно возрастает в присутствии стехиометрических количеств F-актина. Фермент актомиозин активируется ионами Mg2 и ингибируется этилендиаминтетраацетатом ( ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны. [27]
Схематическое изображение модели приведено на рис. 5.19 и 5.20. Сформулируем основные исходные положения. Сокращение связано с фосфори-лированием и дефосфорилированием миозина. В частности, прямой гидролиз фосфориамиозина активирует миозин. Форма головки молекулы миозина изменяется при добавлении АТФ. Связь F-актин - миозин легко расщепляется с образованием комплекса миозин - АТФ при высоких концентрациях АТФ или комплекса миозин - фосфат - АДФ при низких концентрациях АТФ. Полный цикл происходит вследствие расщепления связи миозин - F-актин после конформа-ционного превращения головки миозина, вызванного выделением энергии. Связь восстанавливается, когда молекула миозина возвращается в свою исходную форму. Как показано на рис. 5.20, Тономура предполагает различную функциональность S - 1A и S - 1B частей ТММ. [28]
Отдельные молекулы актина называют G-актином. Образующаяся длинная гибкая двойная слираль делает полуоборот на расстояниях 360 - 370 А. Природа связей между молекулами G-актина в такой полимерной цепи изучена плохо. Некоторые исследователи считают, что в полимерной цепи F-актина молекулы G-актина образуют димеры с молекулярной массой 1200 дальтон и размерами 105 X 37 X 27 А. Укладываются такие молекулы под углом так, что образуется период, равный 55 А. [29]
Схематическое изображение модели приведено на рис. 5.19 и 5.20. Сформулируем основные исходные положения. Сокращение связано с фосфори-лированием и дефосфорилированием миозина. В частности, прямой гидролиз фосфориамиозина активирует миозин. Форма головки молекулы миозина изменяется при добавлении АТФ. Связь F-актин - миозин легко расщепляется с образованием комплекса миозин - АТФ при высоких концентрациях АТФ или комплекса миозин - фосфат - АДФ при низких концентрациях АТФ. Полный цикл происходит вследствие расщепления связи миозин - F-актин после конформа-ционного превращения головки миозина, вызванного выделением энергии. Связь восстанавливается, когда молекула миозина возвращается в свою исходную форму. Как показано на рис. 5.20, Тономура предполагает различную функциональность S - 1A и S - 1B частей ТММ. [30]
Страницы: 1 2 3