Гидроокись - ртуть
Cтраница 1
Гидроокиси ртути и серебра, как это указывалось выше, настолько неустойчивы, что в момент своего образования распадаются на соответствующий окисел и воду. Гидроокись меди теряет воду при нагревании, а для гидроокисей висмута, олова и сурьмы характерно частичное обезвоживание. [1]
Гидроокись ртути неустойчива, она сразу разлагается на оксид и воду. [2]
Гидроокиси ртути и серебра, как это указывалось выше, настолько неустойчивы, что в момент своего образования распадаются на соответствующий окисел и воду. Гидроокись меди теряет воду при нагревании, а для гидроокисей висмута, олова и сурьмы характерно частичное обезвоживание. [3]
Гидроокиси ртути не стойки, и в чистом виде не получены. [4]
Гидроокиси ртути нестойки и в чистом виде не получены. В щелочных растворах ионы ртути образуют нерастворимые окислы. В соединениях одновалентной ртути, структуру которых удалось выяснить, два атома ртути связаны непосредственно. [5]
Гидроокиси ртути и серебра, как это указывалось выше, настолько неустойчивы, что в момент своего образования распадаются на соответствующий окисел и воду. Гидроокись меди теряет воду при нагревании, а для гидроокисей висмута, олова и сурьмы характерно частичное обезвоживание. [6]
Аналогичная им гидроокись ртути [ Hg ( OH) 2 ] отщепляет воду уже в момент образования. [7]
Ниже будет показано, что гидроокись ртути можно удалить с поверхности электрода химическим путем и затем зарегистрировать полярограмму электрохимического восстановления хлорида и бромида ртути. [9]
 |
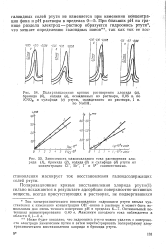
Поляризационные кривые катодного растворения ( и 0 011 в / сек вольфрамата ( а, молибдата ( б, ванадата ( в и хромата ( г ртути, осажденных из растворов, 0 1 н. по NaNO3. [10] |
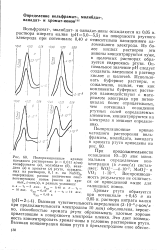
Из более кислых растворов эти анионы концентрируются хуже, в щелочных растворах образуется гидроокись ртути. Оптимальное значение рН следует создавать введением в раствор кислот и щелочей. Использовать буферные растворы, к сожалению, нельзя, так как компоненты буферных растворов взаимодействуют с материалом электрода при потенциалах более отрицательных, чем потенциал осаждения ртутных солей определяемых элементов, концентрируются на электроде и мешают определению. [11]
Едкие щелочи NaOH и КОН образуют с солями ртути ( II) желтый осадок HgO, так как гидроокись ртути неустойчива ( ср. [12]
Едкие щелочи NaOH и КОН образуют с солями ртути ( II) желтый осадок HgO, так как гидроокись ртути неустойчива ( ср. [13]
Едкие щелочи NaOH и КОМ образуют с солями ртути ( II) желтый осадок HgO, так как гидроокись ртути неустойчива ( ср. [14]
Едкие щелочи NaOH и КОН образуют с солями ртути ( II) желтый осадок HgO, так как гидроокись ртути неустойчива ( ср. [15]
Страницы: 1 2