Труднорастворимая гидроокись
Cтраница 3
Этим методом широко пользуются при получении золей различных металлов из их солей, если в результате реакции гидролиза образуется труднорастворимая гидроокись. [31]
В третью аналитическую группу входят ионы А13 и Сг3, дающие с NH - sOH или с сульфидом аммония труднорастворимые гидроокиси, а также Mn44, Fe44, Fe3, Co44, Ni44 и Zn44 - катионы, образующие с ( NrL) 2S в нейтральной или слабо щелочной среде труднорастворимые сульфиды этих металлов, которые, однако, легко растворяются в разбавленных кислотах, чем и отличаются от катионов четвертой л пятой групп. [32]
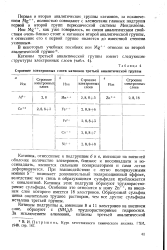 |
Строение электронных слоев катионов третьей аналитической группы. [33] |
Катионы подгруппы а, имеющие 8 и 11 электронов на внешнем слое, образуют с ( NH4) 2S труднорастворимые гидроокиси. [34]
 |
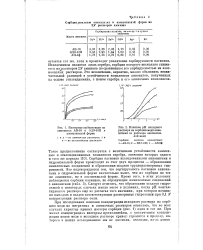
Строение электронных слоез кати шов III аналитической группы. [35] |
Катионы подгруппы а, имеющие 8 или 11 электронов во внешнем слое, образуют с ( NH) 2S труднорастворимые гидроокиси. За исключением алюминия, катионы III аналитической группы расположены в четвертом периоде таблицы Менделеева. [36]
 |
Изотермы сорбции меди на.| Влияние рН исходного раствора на сорбцию меди анио-нитами из раствора азотнокислой меди. [37] |
Сорбция катионов исследованными анионитами в гидроксильной форме происходит за счет двух процессов - образования комплексных соединений и образования осадков труднорастворимых гидроокисей. Это подтверждается тем, что сорбируемость катионов анионитами в гидроксильной форме значительно выше, чем их сорбция на тех же анионитах, но в азотнокислой форме. Следует отметить, что образование осадков гидроокисей в некоторых случаях имело место в условиях, когда рН контак-тируемого раствора еще но достигал того значения, при котором начинают выпадать в осадок соответствующие растворимые гидроокиси при 0 1 N концентрации раствора соли. [38]
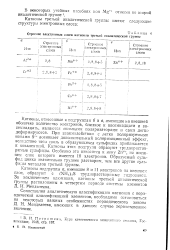 |
Строение электронных слоев катионов третьей аналитической группы. [39] |
Катионы подгруппы а, имеющие 8 и 11 электронов на внешнем слое, образуют с ( NH, ) 2S труднорастворимые гидроокиси. [40]
Как предполагают Дженни и Вигнер, аномалию можно объяснить последующей реакцией этих оснований на дающем щелочную реакцию плавленом пермутите с образованием труднорастворимых гидроокисей, которая протекала бы до образования постепенно замещающегося силиката. [41]
 |
Иллюстраций 3. Библ. 6 назв.| Иллюстраций 4. Библ. 6 назв. [42] |
Изучено влияние свойств раствора на сорбцию ионов металлов некоторыми анионитами за счет образования твердых комплексов катионов тяжелых металлов со слабоосновными амин-ными группами анионитов и образования труднорастворимых гидроокисей. Исследована возможность извлечения солей меди из их аммиачных растворов в динамических условиях Медь сорбировалась за счет комплексообраэования. [43]
Переходные металлы V группы - ниобий и тантал, - образующие ионы Nb5 и Та5 с внешней конфигурацией s2pe, осаждаются сульфидом аммония в виде труднорастворимых гидроокисей и относятся к первой подгруппе III аналитической группы. Ванадий образует ион V4, выделяется в виде сульфида и относится ко второй подгруппе той же III группы. Таким образом, несмотря на пониженную валентность иона V4, он по аналитическим признакам смещен вправо относительно ниобия и тантала. Празеодим, диспрозий, протактиний образуют катионы с внешней s2pe - конфигурацией и относятся к первой подгруппе III аналитической группы. [44]
Все гидроокиси катионов 4 - й группы, за исключением РЬ ( ОН) 2, проявляют резко выраженный основной характер и при действии щелочи осаждаются в виде труднорастворимых гидроокисей, причем дальнейшее прибавление реактива-осади-теля не приводит к заметному растворению осадка. [45]
Страницы: 1 2 3 4