Ia-подгруппа
Cтраница 1
Металлы IA-подгруппы широко используются в новой технике. [1]
Элементы IA-подгруппы - литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr - выделяются среди элементов других А-подгрупп наибольшим сходством физических и химических свойств. Их объединяют под общим названием щелочные металлы, так как их гидроксиды - сильные, хорошо растворимые основания - щелочи. [2]
К IA-подгруппе относятся s - элементы: литий, натрий, калий, рубидий, цезий и франций, называемые щелочными металлами, так как гидроксиды некоторых из них издавна известны как щелочи. [3]
 |
Свойства металлов IB-подгруппы. [4] |
Подобно элементам IA-подгруппы, медь, серебро и золото имеют по одному электрону на s - подуровне внешнего уровня, но очень мало похожи на щелочные металлы, а сходны с предшествующими элементами VIIIB-подгруппы. [5]
Все металлы IA-подгруппы обладают малой плотностью. [6]
 |
Растворимость гидроксидов шелочных металлов. [7] |
Гидроксиды металлов IA-подгруппы представляют собой бесцветные кристаллические вещества. Их сила возрастает от LiOH к CsOH с увеличением радиуса катиона. За исключением LiOH, гидроксиды щелочных металлов термически устойчивы до температур выше 1000 С. [8]
Эта особенность электронного строения катионов элементов IA-подгруппы позволяет рассматривать их при образовании химических связей в виде идеальных сфер - шаров. [9]
Как и следовало ожидать, минимумы на кривой соответствуют элементам IA-подгруппы. Это объясняется сильным экранированием заряда ядра электронными оболочками, предшествующими внешнему электрону. Уменьшение же энергии ионизации в ряду Li-Cs вызвано ростом атомных радиусов. [10]
Температуры плавления металлов в периодах системы Д. И. Менделеева сначала возрастают, начиная с простых веществ металлов IA-подгруппы, и достигают максимума у простых веществ металлов VIB-подгруппы, где находится самый тугоплавкий металл - вольфрам. [11]
Деформируемость при небольших нагрузках характерна для металлов, сочетающих пластичность с малой вязкостью, например для металлов IA-подгруппы. Механически прочные металлы деформируются только под действием больших нагрузок. [12]
Во внешнем слое атомов всех элементов всегда содержатся s - электроны - большей частью в конфигурации ns2; конфигурация ns1 характерна только для элементов IA-подгруппы и для элементов, отмеченных в пп. [13]
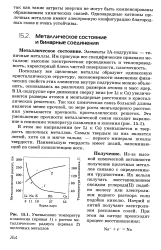 |
Уменьшение температур плавления ( кривая 1 с ростом металлического радиуса ( кривая 2 щелочных металлов. [14] |
Поскольку все щелочные металлы образуют одинаковую кристаллическую структуру, закономерности изменения физических свойств этих элементов внутри подгруппы можно объяснить, основываясь на различиях размеров атомов и масс ядер. В IA-подгруппе при движении сверху вниз ( от Li к Cs) увеличиваются размеры атомов и межъядерные расстояния в кристаллических решетках. Так как химическая связь большей длины является менее прочной, по мере роста межъядерного расстояния уменьшается прочность кристаллических решеток. [15]
Страницы: 1 2