Ia-подгруппа
Cтраница 2
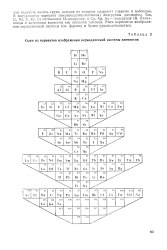 |
Один из вариантов изображения периодической системы элементов. [16] |
В полудлинном варианте ( восемнадцатиклеточиом) подгруппы разделены. Ro, Cs составляют IA-подгруппу, a Cu, Ag, Аи - подгруппу IB. Лантаноиды и актиноиды вынесены вне основной таблицы. [17]
Периодическая система элементов состоит из 8 групп, каждая из которых подразделена на главную и побочную подгруппы. Так, в главной подгруппе I группы ( IA-подгруппа) сосредоточены сходные по химическим свойствам щелочные металлы. Отличаются они между собой атомной массой, а следовательно, интенсивностью химических свойств: с увеличением атомной массы повышается их химическая активность. В побочной подгруппе ( IB-подгруппа) также находятся металлы, но они в противоположность щелочным металлам обладают низкой химической активностью. С увеличением атомной массы их активность падает. Так, медь Си легко реагирует с азотной кислотой НМОз, в то время как золото Аи с ней не взаимодействует. [18]
Чем слабее связаны эти электроны в атоме, тем меньше энергии требуется для их отрыва. Поэтому фотоэлектрический эффект лучше всего выражен у металлов IA-подгруппы. [19]
С позиций строения атома объяснимо положение водорода в периодической системе. Атом водорода имеет один внешний электрон, который может быть отдан атомам других элементов. Поскольку это свойство проявляют атомы всех элементов, начинающих периоды - Li, Na, К, Rb, Cs Fr, то и водород должен стоять в IA-подгруппе. Так как в этом случае водород проявляет неметаллические свойства, он должен находиться в VIIA-подгруппе. Эта двойственность в химическом поведении водорода заставляет помещать его в двух группах периодической системы элементов. При этом в одной из групп символ элемента заключают в скобки. [20]
Однако твердость их различна и, как и тугоплавкость, обусловливается прочностью пространственной кристаллической решетки. Наиболее твердые - простые вещества металлов VIB-подгруппы; так, хром по твердости приближается к алмазу. Наименее твердые - простые вещества металлов IA-подгруппы. Твердость металлов определяет возможность использования их в качестве конструкционных и инструментальных материалов. [21]
Этот элемент отличается от других щелочных металлов наименьшими размерами атома и иона. Наружный электронный слой катиона имеет два электрона ( структура [ Не ]), а не восемь, как другие щелочные металлы. Поэтому литий проявляет некоторые отличия в своих свойствах от других щелочных металлов. При горении на воздухе образует оксид Li20, в то время как другие щелочные металлы образуют пероксиды и надпероксиды. Растворимость литиевых солей заметно отличается от растворимости солей других элементов IA-подгруппы. Так как катион Li прочнее других катионов щелочных металлов удерживает молекулы воды, он образует с Cl -, Br -, I, NO3, СЮ4 кристаллогидраты, в которых на каждый катион соли приходится три молекулы воды. По всем этим свойствам литий напоминает магний. [22]
Страницы: 1 2