Iva-группа
Cтраница 3
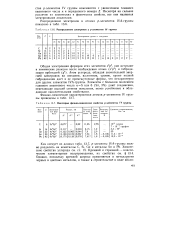 |
Распределение электронов у р-элементов IV группы.| Некоторые физико-химические свойства р-элементов IV группы. [31] |
Атом углерода, обладая значительной энергией электронов на внешнем, валентном, уровне, кроме полной гибридизации дает и ее промежуточные формы, что нехарактерно для других элементов IVA-группы. Элементы с большим значением главного квантового числа п 5 или 6 ( Sn, Pb) дают соединения, отвечающие высшей степени окисления, менее устойчивые и обладающие окислительными свойствами. [32]
 |
Периодическая система элементов Д. И. Менделеева. [33] |
Таким образом, в этой форме периодической системы элементов титан, цирконий и гафний, рассмотренные нами ранее в качестве примера, оказываются в IVB-rpynne, расположенной достаточно далеко от IVA-группы, в которой находятся углерод, кремний, германий, олово и свинец. Высшие степени окисления тех и других ( 4) совпадают, и их соединения в этих степенях окисления имеют сходные свойства. Однако валентные электроны расположены на разных подуровнях, как это мы увидим далее, что и создает специфические свойства элементов. Менделеев) естественным образом замыкает периоды. [34]
Таким образом, в этой форме периодической системы элементов титан, цирконий и гафний, рассмотренные нами ранее в качестве примера, оказываются в IVB-группе, расположенной достаточно далеко от IVA-группы, в которой находятся углерод, кремний, германий, олово и свинец. [35]
Следует указать, что это не единственный метод обозначения групп, и, например, в металлофизике принято обозначать группы по порядку, тогда, например, титан будет в IVA-группе, а кремний - в IVB. Обе системы обозначения групп широко применяются. [36]
Можно было бы ожидать, что замещение атомов хлора на аминогруппу должно протекать значительно легче тогда, когда связь М - С1 имеет заметный ионный характер, но степень ион-ности связи галогенидов IVA-группы закономерно возрастает от SiCl4 к ТЬСЦ. [37]
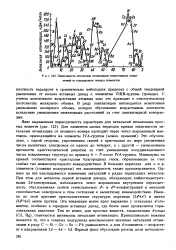 |
Зависимость энтальпии атомизации гомоатомных соединений от порядкового номера элементов. [38] |
Это обусловлено, с одной стороны, упрочнением связей в кристаллах по мере увеличения числа валентных электронов от одного до четырех, а с другой - уменьшением прочности кристаллической решетки за счет уменьшения координационного числа ковалентных структур по правилу 8 - N после IVA-группы. Минимумы на кривой соответствуют кристаллам благородных газов, образованным за счет слабых сил межмолекулярного взаимодействия. В больших периодах для s - и р-элементов ( главные подгруппы) эта закономерность также просматривается. Однако на нее накладывается изменение энтальпий в рядах переходных металлов. При этом для металлов первой вставной декады, обладающих кайносимметрич ными ЗЛ-электронами, наблюдается четко выраженная внутренняя периодичность, обусловленная особой стабильностью Р - и ( / - конфигураций и меньшей способностью электронов в этом состояний к валентному взаимодействию. Именно по этой причине кристаллические структуры марганца ( 3.4 s2) и цинка ( 3P 4s2) менее прочны. Эта тенденция менее ярко выражена у остальных rf - эле-ментов, особенно в середине вставных декад, где более явно проявляется горизонтальная аналогия. Тем не менее, для простых веществ, замыкающих rf - ряды ( Cd, Rg), отмечаются минимумы энтальпии атомизации. [39]
 |
Зависимость энтальпии атомизации гомоатомных соединений от порядкового номера элементов. [40] |
Это обусловлено, с одной стороны, упрочнением связей в кристаллах по мере увеличения числа валентных электронов от одного до четырех, а с другой - уменьшением прочности кристаллической решетки за счет уменьшения координационного числа ковалентных структур по правилу 8 - N после IVA-группы. Минимумы на кривой соответствуют кристаллам благородных газов, образованным за счет слабых сил межмолекулярного взаимодействия. В больших периодах для s - и р-элементов ( главные подгруппы) эта закономерность также просматривается. Однако на нее накладывается изменение энтальпий в рядах переходных металлов. При этом для металлов первой вставной декады, обладающих кайносимметрич-ными 3 / - электронами, наблюдается четко выраженная внутренняя периодичность, обусловленная особой стабильностью ( / 5 - и f - конфигурации и меньшей способностью электронов в этом состоянии к валентному взаимодействию. Именно по этой причине кристаллические структуры марганца ( 3P4s2) и цинка ( 3i104s2) менее прочны. Эта тенденция менее ярко выражена у остальных ( / - элементов, особенно в середине вставных декад, где более явно проявляется горизонтальная аналогия. Тем не менее, для простых веществ, замыкающих rf - ряды ( Cd, Hg), отмечаются минимумы энтальпии атомизации. [41]
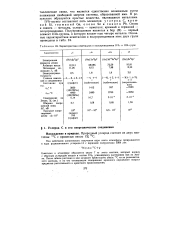 |
Характеристики неметаллов и полупроводников IVA - и ША-групп. [42] |
В результате образуются простые вещества, являющиеся металлами. IVA-группу составляют пять элементов: углерод С, крем-н и и Si, германий Ge, олово Sn и свинец РЬ. [43]
К IVA-группе элементов помимо типических относятся элементы подгруппы германия: Ge, Sn и РЬ. Их валентная электронная конфигурация ( ns2np2 в невозбужденном состоянии) обусловливает возможность проявления свойств и катионо - и анионообразователей. Однако преимущественная ковалентная связь в кристаллах соединений реализуется далеко не всегда. Поэтому тяжелые представители этой группы ( Sn, Pb), т.е. элементы с большой атомной массой, характеризуются плотноупакованными структурами в свободном состоянии. [44]
Элементарные вещества и соединения некоторых р-элементов имеют большое значение для новой техники. Например, элементы IVA-группы кремний и германий - полупроводники; широко применяется в промышленности алмаз. [45]
Страницы: 1 2 3 4