Антрахинондиазол
Cтраница 1
Возникновение люминесценции у антрахинондиазолов, по-видимому, обусловлено двумя структурными факторами. С одной стороны, благодаря образованию конденсированной системы, включающей азольный цикл и соседнее с ним ароматическое ядро, удлиняется я-система, связанная с карбонильной группой. С другой стороны, с карбонильной группой взаимодействует по цепи сопряженных связей электронодонорный заместитель. Однако для появления у антрахинондиазолов интенсивной люминесценции недостаточно введения незамещенной аминогруппы. Для этого необходимы более сильные электронодонорные заместители - алкиламино -, циклоалкиламино - или диалкиламино-грушш. [1]
Строение продуктов аминирования антрахинондиазолов и 2-арил-антрахинонтриазолов установлено на основе превращений их 4-и 5-галоидпроизводных. Как известно, атом галогена в а-положении антрахинона замещается при реакции с аминами, как правило, намного легче, чем в р-положении. На этом основании следовало ожидать, что атом хлора будет особенно подвижен в положении 5 антрахинондиазолов. В действительности же хлор замещается лишь в положении 4, а в положении 5 вовсе не обменивается. В каждой серии соединений ( ХО, S, Se) при взаимодействии с цик-логексиламином 4-хлорпроизводного XCIX и соответствующего незамещенного хинона получено одно и то же аминосоединение CXI, а из 5-хлорпроизводного - хлорсодержащее вещество CXV, синтезированное также хлорированием CXI хлористым сульфурилом. [2]
Описанная выше реакционная способность антрахинондиазолов имеет много общего с реакционной способностью производных антра-хинона, содержащих циклы пиридина и пиразина. [3]
Диалкиламиногруппы смещают спектры поглощения и люминесценции антрахинондиазолов в сторону длинных волн по сравнению с метиламино - и циклогексиламинозамещенными. Это смещение увеличивается при переходе от диметиламино - к диэтиламиноантра-хинондиазолам. [4]
Метиламино - и циклогексиламиногруппы вызывают одинаковый эффект в спектрах поглощения антрахинондиазолов, но цикло-гексиламинозамещенное люминесцирует в более коротковолновой области ( ср. [5]
Поскольку ни антрахинон, ни антрадиазолы не изменяются в условиях превращения антрахинондиазолов, очевидно, что реакционная способность последних вызывается взаимным влиянием гетеро-цикла и хинонной группировки. Наличие конденсированного элек-трофильного гетероцикла повышает сродство хинона к электрону, что особенно ярко проявляется в антрахиноноксадиазолах, гетероцикл которых обладает наибольшей электроотрицательностью. Согласно литературным данным184 185, воздействие конденсированного фуразанового кольца в этом отношении приблизительно эквивалентно введению нитрогруппы. Ядро антрихинона в свою очередь, судя по подвижности связанного с ним галоида186, близко нитробензолу. [6]
Поскольку ни антрахинон, ни антрадиазолы не изменяются в условиях превращения антрахинондиазолов, очевидно, что реакционная способность последних вызывается взаимным влиянием гетеро-цикла и хипонной группировки. Наличие конденсированного элек-трофильного гетероцикла повышает сродство хинона к электрону, что особенно ярко проявляется в антрахиноноксадиазолах, гетероцикл которых обладает наибольшей электроотрицательностью. Согласно литературным данным184 - 185, воздействие конденсированного фуразанового кольца в этом отношении приблизительно эквивалентно введению нитрогруппы. Ядро антрихинона в свою очередь, судя по подвижности связанного с ним галоида186, близко нитробензолу. [7]
Поляризуемость можно оценить, рассмотрев данные по влиянию растворителей на электронные спектры антрахинондиазолов, содержащих в положении 4 электронодонорный заместитель. Чувствительность аминоантрахинондиазолов к увеличению полярности растворителя, характеризующая разность энергий сольватации и, соответственно, разность в полярности возбужденного и основного состояний, возрастает в зависимости; от природы гетероатома X в ряду: О S Se. В той же последовательности изменяется активность незамещенных антрахинондиазолов по отношению к нуклеофильным агентам. Симбатность изменения поляризуемости эт-электронной системы антрахинондиазолов под воздействием внешнего электрического поля с их реакционной способностью отражает, по-видимому, роль электромерного эффекта в реакциях нуклеофильного присоединения. [8]
Поляризуемость можно оценить, рассмотрев данные по влиянию растворителей на электронные спектры антрахинондиазолов, содержащих в положении 4 электронодонорный заместитель. Чувствительность аминоантрахинондиазолов к увеличению полярности растворителя, характеризующая разность энергий сольватации и, соответственно, разность в полярности возбужденного и основного состояний, возрастает в зависимости от природы гетероатома X в ряду: О S Se. В той же последовательности изменяется активность незамещенных антрахинондиазолов по отношению к нуклеофильным агентам. Симбатность изменения поляризуемости л-электронной системы антрахинондиазолов под воздействием внешнего электрического поля с их реакционной способностью отражает, по-видимому, роль электромерного эффекта в реакциях нуклеофильного присоединения. [9]
В отличие от реакций производных антрахинона, содержащих циклы пиридина и пиразина, взаимодействие антрахинондиазолов с бензолсульфинат - или тиофенолят-анионами гладко протекает в отсутствие протонных кислот. [10]
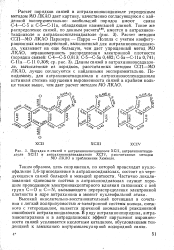 |
Порядки я-связей в антрахиноноксадиазоле ХСП, антрахинонтиади-азрле ХСШ и антрахинонселенадиазоле XCIV, рассчитанные методом МО ЛКАО в приближении Хюккеля. [11] |
Высокий окислительно-восстановительный потенциал в сочетании с легкой поляризуемостью л-электронной системы кольца, смежного с гетероциклом, является причиной аномальной реакционной способности антрахинондиазолов. В ряду антрахинонпиридина, антра-хинонпиразина и в антрадихинонах эффект нарушения выравненное связей усиливается кислотным катализом, обусловленным тенденцией к замыканию внутримолекулярной водородной связи. [12]
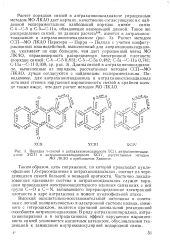 |
Порядки я-связей в антрахиноноксадиазоле ХСП, антрахинонтиади. [13] |
Высокий окислительно-восстановительный потенциал в сочетании с легкой поляризуемостью л-электронной системы кольца, смежного с гетероциклом, является причиной аномальной реакционной способности антрахинондиазолов. В ряду антрахинонпиридина, антра-хинонпиразина и в антрадихинонах эффект нарушения выравнен-ности связей усиливается кислотным катализом, обусловленным тенденцией к замыканию внутримолекулярной водородной связи. [14]
Проведенное сопоставление модельных соединений приводит к заключению, что тенденция к замыканию водородной связи в про-гонированной форме производных антрахинона должна убывать в последовательности: антрахинонпиридины антрахинонпирази-ны дихиноны антрахинондиазолы. Для антрахинондиазолов, в отличие от остальных рассмотренных хинонов, возникновение внутримолекулярной водородной связи не может играть существенной роли. [15]
Страницы: 1 2