Группа - железо
Cтраница 2
Металлы группы железа ( III) не образуют с дитизоном устойчивых соединений. Если проводят экстракцию в аммиачной или в щелочной среде, то осаждаются гидроокиси этих металлов и мешают экстракции. [16]
Элементы группы железа занимают по своим валентным свойствам промежуточное положение между редкоземельными элементами и элементами групп палладия н платины. В их атомах d - элек-троны расположены сравнительно глубоко и в целом ряде соединений вовсе не принимают участия в валентной связи. В этих соединениях, следовательно, элементы группы железа ведут себя подобно редкоземельным элементам. Сюда относятся соединения ионного типа например, FeQ2, РеСУ, в которые атом металла входит в вяде простого катиона. Подобно редкоземельным элементам, элементы группы железа в этих соединениях могут проявлять самые различные валентности. [17]
В группу железа обыкновенно включают уран U 120, потому что этот довольно редкий в природе металл образует закись UO и окись 1Р03, как элементы железной группы; притом оба окисла дают соответственные соли с кислотами, а закись окислением легко переходит в окись. Сверх того, металлический уран имеет плотность 18 4, а вес атома 120, а потому объем его атома равен 6.5, и, таким образом, объем его атома близок... Его окислы и соли окрашены, как у всех других элементов железного ряда. Но при этом сходстве с элементами железной группы уран представляет и немало отличительных признаков, заставляющих с осторожностью допускать сближение его с железом. [18]
Потенциалы металлов группы железа в водных растворах собственных солей определяются, по меньшей мере, шестью электродными реакциями: Ме - 2е - Ме2; Ме2 2е - Ме; 0 5Н2 - е - Н; Н е - О. [19]
Выделение металлов группы железа требует высокого потенциала поляризации катода. Это явление объясняют разнообразными причинами [8, 50]: ингибирующим действием выделяющегося совместно с металлом водорода; образованием устойчивой водородной пленки или гидрата на поверхности металла; малой скоростью дегидратации ионов при разряде на катоде; химической поляризацией; адсорбцией чужеродных частиц; сложным механизмом разряда никеля, включающим стадии образования и восстановления на катоде гидрата никеля. [20]
Потенциалы металлов группы железа в растворах их солей не соответствуют расчетным равновесным потенциалам, так как они менее отрицательны и неустойчивы. Токи обмена значительно снижены из-за наличия пассивирующих пленок. При анодной поляризации даже в нейтральных растворах собственных солей эти металлы склонны к сильной пассивации, которая может привести к значительному снижению Вта. [21]
Окислы металлов группы железа могут взаимодействовать, в частности, с окислами алюминия и хрома, применяемыми часто в качестве носителей при производстве катализаторов, и образовывать шпинели - алюминаты и хромиты. [22]
Для металлов группы железа сероводород ускоряет протекание как катодного, так и анодного процессов и стимулирует наводороживание. [23]
Сплавы металлов группы железа с редкоземельными металлами, представляющие собой интерметаллические соединения с исключительно высокой кристаллографической анизотропией. Cos и foCoir разработаны магнитотвердые материалы с рекордными значениями всех основных магнитных свойств при удовлетворительных характеристиках температурной и временной стабильности. Практическое применение нашли материалы с одноосной анизотропией, изготовляемые методами порошковой металлургии. [24]
В атомах группы железа, лантанидов и актинидов происходит достройка глубоких d - и f - состояний. Однако это отнюдь не строгий закон, так как в некоторых случаях при образовании химических соединений электроны из глубоких состояний переходят во внешние и начинают участвовать в валентности. Особенно отчетливо это проявляется у некоторых актинидов. Поэтому химические свойства элементов с особыми свойствами групп довольно сложны. [25]
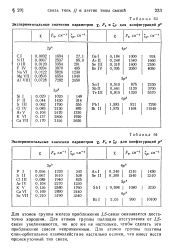 |
Экспериментальные значения параметров, рг и. / для конфигураций /. 2.| Аля конфигураций р9. [26] |
Для атомов группы железа приближение / 5-связи оказывается достаточно хорошим. Для атомов группы палладия отступления от LS-связи увеличиваются, но все же не настолько, чтобы сделать это приближение совсем неприменимым. Для атомов группы платины спин-орбитальное взаимодействие настолько велико, что имеет место промежуточный тип связи. [27]
Силициды металлов группы железа ( железа, кобальта, никеля), как и близкие к ним силициды марганца, обладают металлическими свойствами и сравнительно низкими температурами плавления. Химические свойства их близки. Изученные более подробно силициды палладия и платины имеют металлический вид и характеризуются еще более низкими температурами-плавления, что указывает на ослабление связей в силицидах металлов VIII группы по сравнению с силицидами переходных металлов IV, V и VI групп. [28]
Для элементов группы железа незаполненным является Sd-слой, для большинства РЗМ незаполнен 4 / - слой. Относительное значение орбитальных и спиновых моментов электронов для ферромагнетиков группы железа и РЗМ различно. [29]
В ферромагнетиках группы железа орбитальный момент в значительной степени заморожен электрическим полем кристаллической решетки и основную роль в создании магнитного момента атома играет спиновый магнитный момент, который в дальнейшем для краткости будем называть спин. Так, например, в незаполненном Зс1 - слое железа имеется 6 электронов; спины пяти из них направлены параллельно друг другу, а одного - антипараллельно. Следовательно, результирующий магнитный момент атома железа равен 4 д-в. [30]
Страницы: 1 2 3 4