Группа - железо
Cтраница 3
Все металлы группы железа в соединениях могут быть двух - и трехвалентны. Электроосаждение осуществляется из растворов двухвалентных соединений. Разряд ионов металлов группы железа сопровождается значительной катодной поляризацией и выделение этих металлов на катоде происходит при значениях потенциалов, которые намного отрицательнее соответствующих равновесных потенциалов. [32]
Потенциалы металлов группы железа в растворах их солей же соответствуют расчетным равновесным потенциалам, так как они менее отрицательны и неустойчивы. Токи обмена значительно снижены из-за наличия пассивирующих пленок. При анодной поляризации даже в нейтральных растворах собственных солей эти металлы склонны к сильной пассивации, которая может привести к значительному снижению Вта. [33]
К металлам группы железа близко примыкает медь, строение атома которой, так же как и у металлов группы железа, допускает переход электрона из слоя - М в слой N. Отдавая один электрон, атом меди приближается по свойствам к атому Аи или Ag, а отдавая два электрона-к атомам группы железа. Двухвалентный ион Си должен быть более активен, чем Си, что и подтверждается экспериментально. [34]
К металлам группы железа близко примыкает медь, строение атома которой, также как и у металлов группы железа, допускает переход электрона из слоя М в слой N. Отдавая один электрон, атом меди приближается по свойствам к атому Аи или Ag, а отдавая два электрона-к атомам группы железа. Двухвалентный ион Си должен быть более активен, чем GU, что и подтверждается экспериментально. [35]
 |
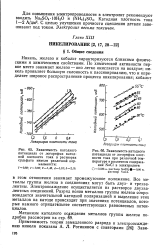
Зависимость катодного и анодного перенапряжений металлов группы железа ( раствор 1 н. MeSO4 от температуры при рН4 5. [36] |
Потенциалы металлов группы железа в растворах их солей не соответствуют расчетным равновесным потенциалам - они менее отрицательны и неустойчивы. Известно, что на потенциалы и перенапряжение при выделении металлов группы железа сильное влияние оказывает температура. При ее повышении потенциал в растворе соли соответствующего металла приближается к расчетному равновесному значению для заданной активности ионов данного металла, а перенапряжение при катодном выделении снижается настолько, что приближается к перенапряжению при выделении, например, меди. [37]
Соли металлов группы железа часто осаждаются вместе с золотом. Для получения чисто золотого покрытия в электролит предлагают вводить щавелевую кислоту, которая регулирует количество соосаждаемого металла. При концентрации щавелевой кислоты в электролите 3 2 г / л соосаждение металлов уменьшается, при концентрации 12 8 г / л полностью подавляется. [38]
Большинство соединений группы железа парамагнитно. [39]
Карбиды металлов группы железа - метастабильные фазы, единственным методом получения которых является взаимодействие металлов или окислов с углеродсодержащими газами. [40]
Для ферромагнетиков группы железа орбитальные моменты Зй-электронов жестко связаны ( заморожены) электростатическим полем решетки и внешнее поле Я, взаимодействуя со спиновыми моментами, преодолевает спин-орбитальное взаимодействие. Таким образом, магнитокристаллическая анизотропия 3d - nepe - ходных металлов обусловлена силами магнитного происхождения. [41]
 |
Образование энергетических зон у натрия.| Образование энергетических зон у лития. [42] |
У металлов группы железа ( Fe, Co, Ni) проводимость значительно ниже, чем у ранее рассмотренных металлов. Причина этого заключается в особенности строения их электронных оболочек. У этих металлов в электропроводности участвуют s - электроны. Но под действием внешнего поля s - электроны могут превратиться в d - электроны и не будут участвовать в электропроводности. [43]
Это элементы группы железа ( Fe, Co, №), так называемые пал-ладиевые ( Ru, Rh, Pd) и платиновые ( Os, Ir, Pt) металлы. Элементы этой группы характеризуются значительным разнообразием электронных конфигураций, состояний окисления, химических свойств. [44]
Для большинства ионов группы железа кристаллическое поле сильнее спин-орбитальной связи и поэтому полностью снимает вырождение орбитального уровня. [45]
Страницы: 1 2 3 4