Карбоксильная группа - молекула
Cтраница 1
Карбоксильная группа молекулы явно асимметрична. Атом водорода присоединен к атому кислорода Oi. В соответствии с этим длина связи Ci - Oi ( 1 34 А) близка к длине одинарной С - 0-связи, а длина связи С - 02 ( 1 17 А) - к длине двойной С 0-связи. [1]
За счет концевых амино - и карбоксильных групп молекул исходных веществ образуются полимеры с высоким молекулярным весом. Из двухосновных кислот и диаминов вырабатывают полиамидные смолы, идущие на производство волокон анид ( нейлон), а из аминокислот и их лактамов - смолы типа капрона и энанта. [2]
Такое строение адсорбционного слоя молекул жирных кислот объясняется в основном силами притяжения между карбоксильной группой молекулы и поверхностью адсорбента, например металла. Только в том случае, когда цепи молекул располагаются перпендикулярно к поверхности адсорбента, эта поверхность приходит во взаимодействие с максимальным числом молекул жирной кислоты, в максимальной степени удовлетворяя их стремлению притянуться к поверхности. [3]
Этот эффект настолько выражен, что атомы азота аминогрупп могут связывать Pt ( II) даже тогда, когда карбоксильные группы молекул лиганда протонированы, как в VII и VIII, в результате чего порядок, выведенный на основании значений рКа, становится обратным. [4]
Так называемые алкидноаминные смолы, представляющие собой в основном сшитые блок-сополимеры, образуются при взаимодействии алкидной смолы с мочевинформальдегидной или меламинформальдегидной смолой; гидроксильные или карбоксильные группы молекулы алкидной смолы реагируют с метилольными или бутоксиметилольными группами аминоформальдегидной смолы. [5]
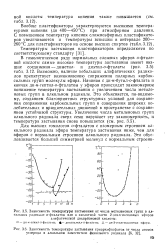
В гомологическом ряду нормальных сложных эфиров о-фтале-вой кислоты самые высокие температуры застывания имеют низшие соединения - диметил - и диэтил-о-фталаты ( рис. 3.5) табл. 3.12. Возможно, наличие небольших алифатических радикалов препятствует возникновению сопряжения полярных карбоксильных групп молекулы эфира. Начиная с ди-н-бутил-о - фталата и кончая ди-н-гептил-о - фталатом у эфиров происходит закономерное понижение температуры застывания с увеличением числа метиле-новых групп в алкильном радикале. Это объясняется, по-видимому, созданием благоприятных структурных условий для сохранения сопряжения карбоксильных групп и совершения широких колебательных и вращательных движений в пространстве с сохранением устойчивой структуры. [7]
Все жирные кислоты ( предельные и непредельные) относятся к категории поверхностно активных веществ. Благодаря наличию карбоксильной группы СООН молекулы жирных кислот полярны. Попадая на металлическую поверхность, молекулы примыкают к ней активными группами СООН, образуя упорядоченные, прочные граничные слои. При большой длине молекул такие слои существенно снижают силы трения. [8]
Поэтому полоску бумаги с нейтральными аминокислотами нужно пришить на анодном краю листа так, чтобы она служила стартовой зоной. При рН 1 9 - 2 0 диссоциация всех карбоксильных групп аминокислотных молекул подавлена, и в связи с этим все нейтральные компоненты смеси ведут себя как катионы. Пришив полоску бумаги, лист переворачивают и лезвием бритвы осторожно вырезают тот его участок, который расположен под пришитой полоской. Это необходимо делать осторожно, чтобы не повредить швы и саму полоску. Затем фильтровальную бумагу смачивают буферным раствором, имеющим рН 1 9 или 2 0, как описано выше. [9]
Молекулы, содержащие как полярные, так и неполярные группы, располагаются таким образом, что первые группы контактируют с водой, а вторые удаляются из водного окружения. Ленг-мюр показал, что так построены мономолекулярные слои жирных кислот на поверхности воды - полярные карбоксильные группы молекул погружены в воду, а неполярные углеводородные радикалы обращены наружу. Та же ситуация определяет структуру мицелл в водных коллоидных растворах мыл: гидрофобные группы располагаются внутри мицеллы, гидрофильные - на ее поверхности. [10]
Если к ацетальдегиду прибавить очень слабый раствор щелочи, то происходит своеобразная реакция. Две молекулы ацетальдегида реагируют друг с другом таким образом, что один водородный атом молекулы II присоединяется к кислороду карбоксильной группы молекулы I, образуется углерод-углеродная связь и получается альдегидоспирт, альдоль. [11]
Мыло является поверхностно-активным веществом. Адсорбируясь на поверхности раздела своего раствора как с воздухом, так и с маслом, оно резко понижает поверхностное натяжение, в результате чего сильно увеличивается устойчивость пены и эмульсии. При этом гидрофильные карбоксильные группы молекул мыла на поверхности раздела находятся в водной фазе, гидрофобные же углеводородные радикалы ориентируются в сторону воздуха, а при наличии контакта с маслом или жиром частично растворяются в нем, способствуя его дроблению на мелкие капли - эмульгированию. Этим объясняется способность водного раствора ныла удалять жировые загрязнения с различных поверхностей. [12]
Четыре карбоксильные группы в молекуле гуминовой кислоты могут отдиссоциировать ионы Н и обменивать их на другие катионы при разных значениях рН - первый ион Н замещается при рН 4 5, второй - при рН 7, третий и четвертый - при рН 9 и выше. Водород фенольных гидроксилов может вытесняться основаниями только при сильнощелочной реакции среды. Следовательно, при кислой и нейтральной реакции в обменном поглощении участвуют только две карбоксильные группы молекулы гуминовой кислоты. Водород их при рН ниже 7 способен отщепляться и замещаться другими катионами ( например, Са) с образованием соответствующих гуматов. [13]
Гумусовые вещества содержат карбоксильные и фенольные гидроксиль-ные ( ОН) группы, водород их может быть замещен другими катионами. Четыре карбоксильные группы в молекуле гуминовой кислоты могут отдиссоциироватъ ионы Н и обменивать их на другие катионы при разных значениях рН - первый ион Н замещается при рН 4 5, второй - при рН 7, третий и четвертый - при рН 9 и выше. Водород фенольных гидроксилов может вытесняться основаниями только при сильнощелочной реакции среды. Следовательно, при кислой и нейтральной реакции в обменном поглощении участвуют только две карбоксильные группы молекулы гуминовой кислоты. Водород их при рН ниже 7 способен отщепляться и замещаться другими катионами ( например, Са) с образованием соответствующих гуматов. [14]
Все работы по биосинтезу флавоноидов подтвердили, что флоро-глюциновое ядро А образуется по ацетатному механизму - конденсацией трех молекул уксусной кислоты. Предполагается участие аце - тилкофермента А или малонилкофермента А. Циклизация остатка ( 5 - поликетокислоты приводит к образованию не идентифицированных до настоящего времени промежуточных продуктов. Наиболее правдоподобно, что фенольные гидроксилы в положениях 5 и 7 происходят от карбоксильных групп молекул уксусной кислоты. [15]
Страницы: 1 2