Функциональная группа - белок
Cтраница 1
Сульфгидрильная функциональная группа белков играет, как известно, важную роль в механизмах функционирования определенных ферментов. Поскольку большинство этих ферментов содержит несколько SH-групп, идентифицировать именно ту сульфгидрильную группу, которая непосредственно осуществляет каталитическую функцию, и определить ее место в аминокислотной цепи - довольно трудная задача. В некоторых благоприятных случаях каталитически активная SH-rpynna оказывается также наиболее химически активной, что может быть обусловлено ее незащищенным положением в третичной структуре фермента или ее окружением. Добавление одного эквивалента реагента на SH-группу, меченного радиоактивным изотопом, должно привести к тому, что помстится интересующая нас SH-группа. Однако SH-группа в активном центре может обладать такой же или меньшей реакционной способностью по сравнению с другими SH-группами, и ее удается пометить лишь при помощи какого-нибудь остроумного метода. Если SH-rpynna, непосредственно участвующая в каталитическом акте, защищена субстратом от алкилирующих агентов, то после предварительного алкилирования всех остальных SH-групп в присутствии субстрата и последующего удаления избытка немеченого алкилирующего агента и субстрата ее можно пометить алкилирующим соединением, содержащим радиоактивную алки-лирующую группу. Этот прием используют только с нативным ферментом, поскольку добавление денатурирующего агента приводит к изменению укладки полипептидной цепи и нарушению специфической конформации активного центра, в результате чего субстрат не в состоянии защитить каталитически активную SH-группу. [1]
Эти функциональные группы белка наиболее часто подвергались исследованиям по следующим причинам: 1) появление свободных сульфгадрильных групп во время денатурации было обнаружено уже давно; 2) активность многих ферментов связана с наличием суиьфшдрильны Х групп; 3) сульфгидрильные группы могут быть легко открыты и поддаются количественному измерению. Был разработан ряд специфических для этой группы методов, включающих окисление, алкилирование и образование мер-каптидов. Эти методы будут описаны в разделе, посвященном денатурации белка. [2]
Доступность функциональных групп белка по отношению к химическим реагентам широко обсуждалась в связи с явлением денатурации. Так как в настоящей статье рассматриваются лишь реакции неизмененных белков и преимущественно реакции очищенных нативных белков, то этот вопрос возникает вновь. Прежде для модификации белка применялись относительно жесткие условия обработки, приводившие к денатурации, а часто и к сопутствующему ей возрастанию числа реакционноспособных групп. В настоящее время разработаны такие методы замещения, которые предотвращают это явление. Однако при определении кажущейся степени замещения важно обеспечить именно полную денатурацию. [3]
Боку, функциональные группы белков, переносящие электроны, способны перемещаться так, словно они закреплены на эластичном стержне, который, нагибаясь то в одну, то в другую сторону, обеспечивает контакт с соседними такими же устройствами и осуществляет этим способом перенос электронов. Корман) что переходы из окисленного в восстановленное состояние кофакторов соответствуют и изменению их положения относительно белковой молекулы, причем новое положение способствует одному из актов приема или отдачи электрона. [4]
Реакции замещения функциональных групп белка должны обязательно привести к изменению его физических свойств ( в первую очередь растворимости и электрохимического поведения), однако биологическая активность белка при этом иногда сохраняется. Херриотт подчеркивает, что при сравнении производного белка с его нативной формой желательно пользоваться рядом критериев. По его мнению, наилучшее доказательство того, что изменение белка обусловлено химической реакцией, а не денатурацией, будет получено в том случае, если удастся показать возможность регенерации свойств исходного белка. Таким образом, имеется ряд критериев для суждения о том, подвергся ли белок денатурации при химическом его изменении. Необходимо отметить, что сохранение активности белка после химической модификации часто является относительным; например кристаллический аце-тилированный пепсин обладает только 60 % протеолитической активности исходного фермента, причем фазовые диаграммы растворимости указывают на присутствие нескольких производных. [5]
Амидная группа - наиболее распространенная функциональная группа белков, поэтому ее возможное участие в качестве компонента активных центров ферментов вызывает несомненный интерес. По своим физико-химическим свойствам амидная группа весьма инертна. [6]
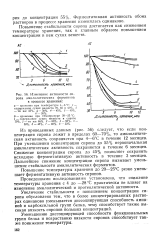 |
Изменение активности сиропа амилолитических ферментов в процессе хранения. [7] |
Уменьшению диссоциирующей способности функциональных групп белка и возрастанию вязкости сиропов способствует также понижение температуры. [8]
Однако, как уже говорилось, функциональные группы белка могут связывать не только протоны, но и другие ионы, как положительные, так и отрицательные. В результате суммарный заряд, найденный по формуле ( 28), даже с учетом всех возможных поправок может значительно отличаться от найденного титрованием, причем эти отличия выходят за пределы ожидаемых ошибок расчета и измерения. В частности, изоэлектрическая точка, определяемая как рН раствора, в котором белок неподвижен в электрическом поле, отличается от изоионной точки, и это отличие тем больше, чем выше ионная сила раствора. [9]
Как известно, ионизирующая радиация действует на функциональные группы белков, вызывая изменения физиологически важных групп. [10]
Было исследовано лишь очень небольшое число превращений одних функциональных групп белка в другие. В то время как применение большинства методов получения производных белков сопровождается радикальными изменениями природы одной или нескольких функциональных групп белка ( нередко с заметным изменением заряда или кислотности), в описываемом случае происходит только замена аминогруппы на гуанидинную группу, обладающую несколько более сильными основными свойствами. [11]
Те же рассуждения относятся и к аминогруппам и вообще ко всем функциональным группам белков. Поэтому кривые титрования белков являются результатом суммирования множества парциальных кривых и выглядят вполне плавно, часто без каких-либо заметных перегибов. Из этих кривых может быть получена информация о заряде белковой макромолекулы как функции рН, но отнести заряд к ионизации определенных групп без дополнительных исследований невозможно. Явление маскирования функциональных групп в третичной структуре белковой глобулы широко известно в белковой химии и чрезвычайно характерно для натнвных белков. Не только электролитическая диссоциация, но и любые другие химические реакции боковых групп белка сильно тормозятся вследствие маскирования функциональных групп третичной структурой. [12]
Образование водородной связи возможно как в ионизированных, так и в незаряженных функциональных группах белка, содержащих электроотрицательные атомы. [13]
Кетен является, повидимому, реагентом, наиболее часто используемым для определения специфичности функциональных групп белка; при применении в случае модификации белков сыворотки, антигенов и антител он стоит в одном ряду с азотистой кислотой и формальдегидом. Около 20 ферментов, гормонов, токсинов и вирусов было ацилировано кетеном. [14]
В связи с этим необходимо указать, что сорбция субстрата на ферменте происходит, как правило, при участии функциональных групп белка, отличных от тех, которые принимают участие в последующей химической реакции. [15]
Страницы: 1 2 3