Функциональная группа - белок
Cтраница 3
Поскольку химические реакции белков обусловлены наличием в их молекуле функциональных групп, характерных и для аминокислот ( карбоксильные и аминогруппы, SH-группы, ОН-груп-пы тирозина и оксякислот и др.) то они должны быть, очевидно, аналогичны реакциям этих же групп свободных аминокислот. Однако реакционная способность полярных групп в боковых цепях белков часто бывает пониженной. Причина этого заключена в том, что функциональные группы белков часто бывают экранированы - прикрыты складками и петлями полипептидных цепей макромолекулы. [31]
Гистохимия, выявление белков производится в ос-I новном с помощью цветных реакций на аминокислоты и входящие в состав белковой молекулы функциональные группы. Для этой цели применяют, например, Миллона реакцию на тирозин, Сакагучи реакцию-па аргинин и др. Большое значение приобрел метод Дапиэлли, основанный на выявлении тирозина, триптофана и гистидипа белка посредством азосояе-танип с бисдиазотированным бензидипом или о-дна-низидином и последующем усилении окраски путем дополнительного азосочетания с Аш-кислотой. Азосо-четание широко используется при осуществлении гистохимия, реакций на амипо -, карбоксильные, тио-ловые и др. функциональные группы белка. [32]
Вилькокс [416] сообщил о том, что метилдиазоацетат и метилдиазоацетамид, которые превращают карбоксильную группу в производное гликолевой кислоты, удовлетворяют многим требованиям, предъявляемым к идеальным реагентам на функциональные группы белка. В реакцию вступают только карбоксильные и сульфгидрильные группы. Если временно блокировать - SH-группы соединениями ртути, то эта реакция становится специфической. Число введенных остатков гликолевой кислоты равно числу прореагировавших карбоксильных групп. Применение этого метода к альбумину сыворотки человека не приводит к сколько-нибудь заметному изменению размеров и формы молекул белка. Согласно электрофоретиче-ским данным, соединение гомогенно, однако если этерифицировать 25 карбоксильных групп, то расширение границы указывает на некоторую статистическую гетерогенность полученного препарата. [33]
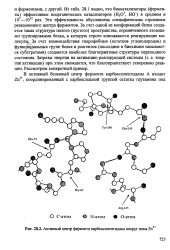 |
Активный центр фермента карбоксипептидазы вокруг иона Zn. [34] |
Эта эффективность обусловлена специфическим строением реакционного центра ферментов. За счет одной из конформаций белка создается такая структура полого ( пустого) пространства, ограниченного атомными группировками белка, в которую строго вписываются реагирующие молекулы. За счет взаимодействия гидрофобных ( остатков углеводородов) и функциональных групп белка и реагентов ( последние в биохимии называются субстратами) создаются наиболее благоприятные структуры переходного состояния. [35]
В каждом из разделов этой статьи, посвященных различным химическим реакциям, приводятся отдельные классические примеры. Полная сводка их имеется в последующих томах настоящего сборника. Однако необходимо еще раз подчеркнуть, что параллелизм между удалением какой-либо функциональной группы белка и потерей активности вовсе не является необходимым следствием существенной связи между ними или ее доказательством. Упоминавшееся выше инактивирование вируса табачной мозаики формальдегидом является только одним из большого числа примеров, доказывающих, что лишь небольшая часть определенных функциональных групп белка связана с его биологической активностью. Кроме того, исследование реакций этого вируса с иодом, кетеном, фенилизоцианатом, карбобензоксихлоридом, п-хлорбензоилхлори-дом, бензосульфохлоридом и динитрофторбензолом показало, что его активность обусловлена не только аминогруппами, но также некоторыми фенольными и индольными группами. Однако Найт [106] отмечает, что, несмотря на эти интенсивные исследования, ни в одном из случаев не удалось найти такую функциональную группу, которая специфически или преобладающим образом определяла бы активность указанного вируса. В самом деле, в случае таких нуклеопротеидов, как вирус табачной мозаики, ролью нуклеиновой кислоты, входящей в их состав, почти полностью пренебрегают. [36]
Изучен биохимический состав золотопоглощающих плесене Установлено, что осадителями золота являются некоторые амин. Химическая активность белке существенно повышается после умеренного обезвоживания щ термокислотной обработки в определенных условиях. Способное ] грибов поглощать не только растворенное, но и коллоидное зод то - следствие ионизации функциональных групп белков в раств. [37]
Ферменты могут ингибироваться либо веществами, вызывающими химические превращения их структуры и приводящими тем самым к их инактивации, либо веществами, которые конкурируют с субстратами за активный центр и в результате замедляют скорость превращения субстрата. Любой процесс, который приводит к удалению фермента из сферы реакции, также замедляет ее скорость. За счет химических превращений сродство фермента к субстрату может не только понижаться, но и повышаться, а это также ведет к изменению кинетики реакции. Такого рода химические превращения могут вызываться ионами металлов, ацилирующими агентами, алкилирующими агентами и любыми другими веществами, взаимодействующими с функциональными группами белка. Изменения, вызванные химическими превращениями, не исчезают при добавлении к ферменту больших количеств субстрата. Ингибирование может быть обратимым, но если реактивация фермента вызвана не действием субстрата, то такой тип ингибирования называют неконкурентным ( noncotnpetitive) ангибированием. Если же фермент инги-бируется при связывании активным центром псевдосубстрата или аналога субстрата, то такое Ингибирование снимается при увеличении в растворе концентрации субстрата, и этот тип ингибирования называют конкурентным ( competitive) ингибирова-нием. Возможен также третий тип ингибирования, когда ингибитор связывается с какой-либо формой фермента, отличной от Е, свободного фермента, например с фермент-субстратным комплексом ES, что приводит к образованию комплекса фермент - субстрат - ингибитор. Ингибирование такого типа должно быть неконкурентным и кинетически отличаться от других типов ингибирования; оно получило название бесконкурентного ( ипсотре - titive) ингибирования. [38]
Важной особенностью солюбилизации углеводородов в белковых системах является влияние на этот процесс кислотности среды. В литературе имеются данные по изучению зависимости растворимости углеводородов в растворах белков от рН среды. Так, В. А. Пчелин с сотрудниками [94-96], изучая солюбилизацию бензола в растворах желатины, обнаружили максимум солюбилизирующего действия при рН, соответствующем изоэлектрической точке белка. Авторы объясняют появление максимума солюбилизации свертыванием разветвленных цепей белка в изоэлектрической точке и образованием глобул, наличие гидрофобного ядра, у которых и обусловливает эффект солюбилизации. В кислой и щелочной средах взаимное отталкивание одноименно заряженных функциональных групп белка приводит к выпрямлению цепей, а следовательно, и снижению солю-билизирующей способности. [39]
Итак, регуляция активных генов осуществляется с помощью различных регуляторных белков-реирессоров и активаторов транскрипции. С физической точки зрения наиболее интересным свойством этих белков является их способность узнавать специфические нуклеотидные последовательности ДНК. Установлено, что в комплексе с регуляторными белками сохраняется обычная 5-подобная конформация ДНК. Узнавание белками их специфических связывающих мест на ДНК основывается на прямом чтении белком последовательности оснований в узкой и / или широкой бороздках ДНК. Специфичность связывания обеспечивается образованием большого числа водородных связей и других слабых взаимодействий между функциональными группами белка и основаниями ДНК. Одна и та же последовательность оснований может быть прочитана как со стороны узкой, так и со стороны широкой бороздки ДНК. Однако характер и пространственное расположение функциональных групп оснований - потенциальных доноров и акцепторов водородных связей - в узкой и широкой бороздках ДНК значительно отличаются. Поэтому часто говорят о двух каналах передачи информации. В узкой бороздке ДНК атомы 02 пиримидинов и N3 пуринов могут служить в качестве акцепторов водородных связей, в то время как 2-аминогруппа гуанина часто является донором водородной связи. Важной особенностью структуры ДНК является пространственная эквивалентность положений всех этих акцепторных групп для пуриновых и пиримидиновых оснований, находящихся в одной и той же полинуклеотидной цепи. Кроме того, атомы N3 пурина и 02 пиримидина в каждой паре оснований связаны осью симметрии второго порядка. Поэтому при чтении текста со стороны узкой бороздки ДНК AT - и ГЦ-па-ры легко узнать, в то время как AT - и ТА-пары различить трудно, так как они несут геометрически эквивалентные группы сходной химической природы. [40]
Как катализаторы, ферменты снижают свободную энергию активации катализируемых ими реакций. Так же как и для некоторых других катализаторов, для них характерен эффект насыщения, заключающийся в том, что при достаточно высокой концентрации реагирующих веществ скорость реакции становится независимой от дальнейшего повышения их концентрации. Но ферменты отличаются от большинства других катализаторов тем, что зависимость их активности от рН и температуры имеет характер, типичный для белков. Графики зависимости активности ферментов от рН имеют перегибы при значениях рК, характерных для ионизирующихся функциональных групп белков. Температура, при которой фермент теряет свою активность, совпадает с температурой, вызывающей разрушение третичной структуры белка. [41]
В большинстве случаев - нелетучие ш высокоплавкие кристаллические продукты. Индигоиды, антрахиноновые кубовые и сернистые легко и обратимо восстанавливаются в щелочной среде, образуя лейкосоединения; нитро -, нитрозо - и азокрасители при этом разрушаются с образованием более токсичных аминов. Ди - и триарилметановые, оке - и тиазиновые, акридиновые при восстановлении обесцвечиваются, а в ряде случаев могут быть окислены в исходные продукты. Высокой реакционной способностью обладают активные красители, способные в очень мягких условиях связываться со спиртами, аминами, функциональными группами белков и ферментов. [42]
Изучение химических реакций белков проливает свет на их структуру. Способность почти всех аминокислотных остатков в белке принимать участие в химических реакциях, аналогичных реакциям аминокислот, подтверждает общепринятую в настоящее время концепцию о том, что основной ковалентной связью в белках является пептидная связь. Однако наличие экранированных групп, обнаруживаемое нрй помстщг денатурации и химических реакций, заставляет предполагать, что некоторые фенольные, сульфгидрильные и др. группы либо образуют лабильные связи, которые могут разрываться при денатурации, либо остаются стерически недоступными для химических реагентов до тех пор, пока структура белка не будет изменена. Последнее объяснение окажется, пожалуй, более приемлемым, если в дальнейших исследованиях будет вскрыта зависимость реакционной способности групп от размера молекул реагента. Тот факт, что для проявления биологической активности существенно важное значение имеет лишь часть функциональных групп определенного вида, подчеркивает сложность топографии белков. Различие в скорости реакций амино - и фенольных групп в ряде белков указывает на индивидуальные особенности структуры белка. В настоящее время не может быть сделан обобщающий вывод о важности тех или иных функциональных групп белка для обеспечения биологической активности. Поэтому для того, чтобы иметь возможность сделать подробные заключения о природе ферментативной активности или вирусного действия, следует еще очень многое изучить. [43]
Страницы: 1 2 3