Двуокись - ванадий
Cтраница 2
Далее, Зигерт отрицает образование ванадатов щелочных металлов в промотированных катализаторах и объясняет влияние щелочных металлов на скорость восстановления пятиокиси ванадия и окисления двуокиси ванадия образованием смешанных кристаллов из сульфатов щелочных металлов и окислов ванадия. Отрицание возможности образования ванадатов щелочных металлов в промотированных ванадиевых катализаторах справедливо лишь в отношении ванадатов, содержащих один или более молей окисла щелочного металла на моль пятиокиси ванадия. [16]
Растворяют 10 г двуокиси ванадия в 130 мл 22 - 25 % - ной бромнстоводородной кислоты при нагревании до 60 - 90 на водяной бане. Фильтрат упаривают в чашке па водяной бане до образования черно-синего вязкого раствора. [17]
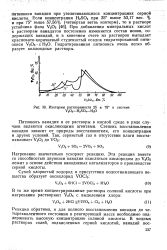 |
Изотермы растворимости 25 и 75 в системе V2O5 - H2SO4 - Н2О. [18] |
Нагревание значительно ускоряет реакцию. Эта реакция вместе со способностью двуокиси ванадия окисляться кислородом до VjOs лежит в основе действия ванадиевых катализаторов в производстве серной кислоты. [19]
Последние быстро ослабевают в ряду Ti-Zr-Hf. Вследствие этого ТЮ2 по характеру взаимодействия с трехокисью урана приближается к двуокиси ванадия и его аналогов, образуя сложный окисел UTiO5 типа соединений уранила. Образуют ли окислы циркония и гафния какие-либо соединения с окислами урана, неизвестно. В подгруппе германия олово и германий с валентностью 4 образуют амфотерные гидраты. При переходе к V группе, в сьязи с возрастающим кислотным характером окислов этих элементов, тенденция к образованию уранатов или сложных окислов типа уранатов заметно ослабевает. Только сурьма и висмут в некоторых соединениях еще проявляют слабые основные свойства. Окись висмута образует несколько соединений с UO3, которые могут быть определены как сложные окислы типа уранатов. Ванадий, ниобий и тантал образуют в системе с кислородом и ураном ванадаты уранила и, по мере понижения кислотного характера пятиокисей, сложные окислы урана с ниобием и танталом типа соединений уранила. [20]
Были основания предполагать [7], что фториды четырехвалентного ванадия будут в целом сходны с фторидами германия или циркония. Однако исследование системы HF - VO2 - Н2О показало, что двуокись ванадия существенно отличается по своему взаимодействию со фтористоводородной кислотой. Тетрафторид ванадия не образуется вплоть до 71 07 % HF. В этом смысле V 4 граничит с элементами, для которых кислородные соединения более характерны и которые в высшем валентном состоянии не образуют фторидов, соответствующих их валентности. К числу таких элементов относятся шестивалентный хром и семивалентный марганец. [21]
Несмотря на обратное распределение изоэлектронных наружных оболочек атомов в модельной паре Ga48 ] Pra048J - А1МА8 [ 18ЮР ], оба соединения тем не менее характеризуются очень близкими значениями параметров элементарных ячеек. Полным изоэлектронным аналогом двуокиси титана ТЮ2 является ванадат ScV04, а рутилоподобной двуокиси ванадия, должно быть, соединение AlGaPAs08, данных о существовании которого пока не имеется. [22]
Возможность образования флюо-ритовой фазы с параметром решетки, отличным от параметра чистой иО2 - подтверждена в работе [20], где в качестве исходных компонентов смеси были взяты двуокись ванадия, полученная спеканием стехиометри-ческих количеств V2Os и У2Оз в течение 60 ч при 750 - 800 С, и двуокись урана, восстановленная из закиси-окиси урана в атмосфере водорода. [23]
При действии на ниобаты и танталаты кислотами получают ни-обиевые и танталовые кислоты, белые студенистые осадки состава Э2О8 Н2О, нерастворимые в воде, но растворимые в щелочах и в кислотах. Это указывает на их амфотерный характер. Для ванадия амфотерным окислом будет сине-черная двуокись ванадия VO2, а окислы V2O3 и VO, черного цвета, - основные. [24]
Руда экстрагируется серной кислотой, растворы обрабатывают окисью цинка, в присутствии которой ванадий почти количественно выпадает в осадо-к. Из осадка ванадий извлекается раствором щелочи. Для восстановления ванадия вводят сперва железный скрап, причем, кроме ванадия, восстанавливаются и выделяются на железе также медь и мышьяк; затем добавляют избыток закиси железа. При стехиометрических соотношениях железа и ванадия образуются коллоидные растворы двуокиси ванадия, при избытке закиси железа выпадает осадок указанного состава. Вся металлическая аппаратура для растворов освинцована, так как растворы сернокислого ванадия быстро разрушают металл. Вы-щелачиватели сделаны из хинного дерева и покрыты асфальтовым лаком. [25]
Правильно оценивая влияние добавок щелочных металлов на скорость реакции, Зигерт заблуждается, предполагая, что промежуточное соединение образует особую фазу. Выше уже подчеркивалось, что промежуточные стадии при гетерогенном катализе не могут рассматриваться как фазовые превращения. Реакции отщепления и связывания кислорода ванадиевыми катализаторами в процессе окисления двуокиси серы протекают на поверхности и не сопровождаются попеременными превращениями кристаллической решетки катализатора. С этой точки зрения опыты Зигерта, исследовавшего влияние различных добавок на скорость восстановления пятиокиси ванадия двуокисью серы и скорость окисления двуокиси ванадия кислородом, не дают сведений о протекании отдельных стадий каталитического процесса, а следовательно, из этих опытов не могут быть сделаны выводы о сравнительной ценности исследованных добавок в качестве промоторов. [26]
Правильно оценивая влияние добавок щелочных металлов на скорость реакции, Зигерт заблуждается, предполагая, что промежуточное соединение образует особую фазу. Выше уже подчеркивалось, что промежуточные стадии при гетерогенном катализе не могут рассматриваться как фазовые превращения. Реакции отщепления и связывания кислорода ванадиевыми катализаторами в процессе окисления двуокиси серы протекают на поверхности и не сопровождаются попеременными превращениями кристаллической решетки катализатора. С этой точки зрения опыты Зигерта, исследовавшего влияние различных добавок на скорость восстановления пятиокиси ванадия двуокисью серы и скорость - окисления двуокиси ванадия кислородом, не дают сведений о протекании отдельных стадий каталитического процесса, а следовательно, из этих опытов не могут быть сделаны выводы о сравнительной ценности исследованных добавок в качестве промоторов. [27]
Химия ванадия очень интересна. Гидроокиси двухвалентного и трехвалентного ванадия обладают основными свойствами, а гидроокиси высших окислительных состояний амфотерны. Соединения ванадия обладают самыми различными окрасками. Ионы двухвалентного ванадия V2 имеют фиолетовый цвет; соединения трехвалентного ванадия, например калиево-ванадиевые квасцы KV ( S04) 2 - 12H20, окрашены в зеленый цвет; двуокись ванадия - вещество темно-зеленого цвета; она растворяется в кислоте с образованием ванадил-иона VO2 синего цвета. Ванадиевый ангидрид 205-вещество оранжевого цвета, применяют в качестве катализатора при контактном методе производства серной кислоты. Важным соединением ванадия является метававадат аммония NH4V03, образующий желтые кристаллы при кристаллизации из раствора. Его применяют при изготовлении препаратов окиси ванадия, используемых в контактном методе производства серной кислоты. [28]
Обнаруженные в работе Бобо [18] пять химических соединений по своим свойствам распадаются на две группы в зависимости от валентности ванадия. Первые легко растворяются в разбавленных кислотах, вторые - только в концентрированных. Наиболее трудно растворим UVO5, он растворяется только в концентрированной горячей серной кислоте. Соединения первой группы термически нестабильны, они плавятся или разлагаются при температурах, близких к температуре плавления VaO5 - UVOs5 плавится с разложением при 750 С, при этом образуется пористый препарат, содержащий UsOs с немного измененными параметрами. Соединения второй группы термически более устойчивы. С, выше которой он разлагается на окисел урана и двуокись ванадия. С разлагается на UVOS и V2O5 в соответствии с валентностью ванадия в исходном соединении. [29]
Страницы: 1 2