Чистая двуокись - титан
Cтраница 1
Чистая двуокись титана ТЮ2 представляет собой белое вещество. В виде порошка она обладает способностью сильно рассеивать свет, благодаря чему приобрела важное значение в качестве пигмента. Ее используют при изготовлении специальных красок и пудры для лица. Кристаллы двуокиси титана ( рутила), окрашенные небольшими количествами других металлических окислов, сравнительно недавно стали использовать в качестве полудрагоценных камней. Тетрахлорид титана TiCl4 при комнатной температуре является молекулярной жидкостью. При распылении в воздухе TiCU гидролизуется с образованием хлористого водорода и мельчайших частиц двуокиси титана. [1]
Чистую двуокись титана в качестве пигмента применяют сравнительно редко как вследствие высокой ее стоимости, так и вследствие недостаточной ее стойкости Б наружных покрытиях. [2]
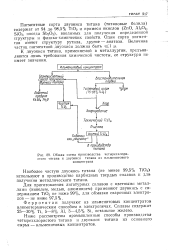 |
Общая схема производства четыреххлори. [3] |
Наиболее чистую двуокись титана ( не менее 99 5 % TiO2 используют в производстве карбидных твердых сплавов и дл получения металлического титана. [4]
 |
Шкала стандартов для определения титана. [5] |
Готовят из чистой двуокиси титана, предварительно прокаленной до постоянной массы. Раствор доводят до метки 10 % раствором серной кислоты. [6]
Процесс получения чистой двуокиси титана довольно сложный. Причем режим прокаливания оказывает большое влияние на свойства Т iO 2 как наполнителя или пигмента для бумаги. Недостатком сернокислого способа является то, что он довольно сложный и требует большого расхода серной кислоты и сопровождается образованием большого количества кислых сточных вод и побочного продукта в виде железного купороса. [7]
Когда берут чистую двуокись титана, к ней нужно добавить 53 - 35 % закись-окиси железа, например взять 28 г закись-окиси и 32 г двуокиси титана. [8]
 |
Химический состав красного шлама. [9] |
Как известно, чистая двуокись титана получается из рутиловой руды хлорированием. [10]
Прокаленный продукт представляет собой почти чистую двуокись титана, которую после охлаждения и размола применяют в качестве пигмента. [11]
Прокаленный продукт представляет собою почти чистую двуокись титана, которая после охлаждения и размола может применяться в качестве пигмента. [12]
По данным работы [23], чистая двуокись титана ТЮ2 начинает заметно взаимодействовать с хлором лишь при 800 С. Максимальные количества прохлорированной ТЮ2 на 1 лС12, по данным работы [25], составляют 0 1 лгпри 800 С, 1 5мг при 900 С, 10 мг при 1000 С. [13]
Стандартный раствор можно приготовить из чистой двуокиси титана ТЮ2, предварительно прокаленной до постоянного веса. В 1 мл этого раствора содержится 0 1 мг титана. [14]
 |
Стандартная шкала для определения четыреххлористого титана. [15] |
Страницы: 1 2 3