Выделившаяся двуокись - углерод
Cтраница 3
К некоторым различиям в поведении полиарилатов при высоких температурах можно отнести: 1) отсутствие водорода в газообразных продуктах деструкции полиарилатов на основе фенолфталеина ( в их составе имеется фталидная группировка) и выделение водорода при деструкции полиарилатов, не содержащих такой группировки; 2) эффективная энергия активации выделения СО2 для полиарилатов на основе фенолфталеина значительно меньше, чем для других полиарилатов; 3) присутствие метильной группы в качестве бокового заместителя у центрального углеродного атома бисфенола ( полиарилат Д-34) приводит к выделению метана в процессе деструкции; 4) присутствие фенильного ядра в качестве бокового заместителя ( полиарилат Д-23) приводит к тому, что в процессе деструкции этого полимера объем выделившейся двуокиси углерода при любых, сколь угодно высоких температурах, всегда превышает объем СО. [31]
Регенерация отработанного абсорбента из первого абсорбера проводится, как описано выше, путем ступенчатого снижения давления. Выделившаяся двуокись углерода отводится через тот же теплообменник. Абсорбер окончательной очистки орошается небольшим количеством метанола, регенерируемого в ректификационной колонне. [32]
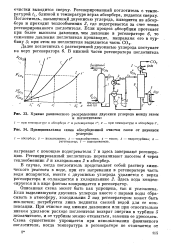 |
Кривые равновесного распределения двуокиси углерода между газом.| Принципиальная схема абсорбционной очистки газов от двуокиси. [33] |
Описанная схема может быть как упрощена, так и усложнена. Если выделившуюся двуокись углерода вместе с парами воды сбрасывать в атмосферу, холодильник 2 над регенератором может быть исключен; потребуется лишь подпитка свежей водой для ее компенсации. При очистке под низким давлением или при относительно низком удельном расходе поглотителя возврат энергии в турбине 5 незначителен, и от турбины можно отказаться, заменив ее дросселем. [34]
Углерод окисляют до двуокиси хроматом свинца при сжигании колчедана или шихты. По объему выделившейся двуокиси углерода определяют содержание углерода в пробе. [35]
Метод основан на окислении углерода до двуокиси углерода хроматом свинца при сжигании колчедана или шихты. По объему выделившейся двуокиси углерода определяют содержание углерода в пробе. [36]
Образовавшаяся в результате горения двуокись углерода поглощается раствором щелочи, а водяные пары конденсируются в воду. По уменьшению объема газа или по количеству выделившейся двуокиси углерода подсчитывают содержание определяемых компонентов. [37]
Расход тетраацетата свинца определяют иодометрическим титрованием ( см. методику 1) 1 0 мл пробы реакционной смеси и пробы холостого опыта. Эта величина ( моль / моль) минус количество выделившейся двуокиси углерода ( моль / моль) дает число молей тетраацетата свинца, израсходованных на окисление 1 моля углевода. [38]
Проведенное недавно исследование механизма реакции изоцианата с водой214 подтвердило вероятность протекания реакции по схемам I и II, предложенным Негели. Оказалось, что при проведении реакции в диоксане при 80 С количество выделившейся двуокиси углерода соответствует приблизительно 50 % израсходованного изоцианата. Разложение ангидрида карбаминовой кислоты при 80 С протекает очень медленно, но уже при 100 С этот процесс значительно ускоряется. [39]
 |
Прибор для определения двуокиси углерода в растворе. [40] |
В реакционном сосуде обрабатывают пробу раствором соляной кислоты. Он соединен с измерительной бюреткой 3 емкостью 250 - 300 см3, в которой измеряется объем выделившейся двуокиси углерода. Компенсационная трубка 5 и уравнительная склянка 6 заполнены подкисленным раствором NaCl, окрашенным несколькими каплями метилового оранжевого. Перед анализом установку проверяют на герметичность, для чего при закрытом трехходовом кране 4 поднимают уравнительную склянку 6 так, чтобы уровень жидкости в бюретке 3 и склянке был на одной высоте, отмечают объем воздуха в бюретке и опускают склянку. Через 5 - 10 мин вновь измеряют объем воздуха в бюретке 3; если он не изменился, то прибор герметичен. [41]
По первой реакции СО2 образуется из р-углерода этильной группы, по второй реакции - из углерода карбоксила. Оказалось, что реакция протекает одновременно по двум направлениям, но с разной скоростью: 75 % выделившейся двуокиси углерода образуется по первой реакции и 25 % - по второй. В зависимости от рН раствора доля участия каждой из реакций в образовании СО2 изменяется. Окисление хромовой смесью приводит к образованию 100 % СО2 по второй реакции. [42]
По первой реакции С02 образуется из р-углерода этильной группы, по второй реакции - из углерода карбоксила. Оказалось, что реакция протекает одновременно по двум направлениям, но с разной скоростью: 75 % выделившейся двуокиси углерода образуется по первой реакции и 25 % - по второй. В зависимости от рН раствора доля участия каждой из реакций в образовании СОа изменяется. Окисление хромовой смесью приводит к образованию 100 % СО2 по второй реакции. [43]
 |
Прибор для определения. [44] |
Реакционный сосуд / - стеклянная банка, внутри которой впаян стаканчик 2, служит для обработки пробы соляной кислотой. Реакционный сосуд соединен с измерительной бюреткой 3 ( 220 - 250 см3), в которой измеряется объем выделившейся двуокиси углерода. Компенсационная трубка 5 и уравнительная склянка 6 заполнены насыщенным раствором хлорида натрия, в который добавлено несколько капель кислоты и метилового оранжевого. [45]
Страницы: 1 2 3 4