Дихло-рид
Cтраница 2
 |
Коэффициенты тушения радиолюминесценции кислородом в зависимости от состава люминофора / 89. [16] |
Та - Ta2Os - SnO2, представляющей собой танталовую фольгу с полученным на ней в водном растворе щавелевой кислоты электрохимическим способом слоем оксида тантала ( V) толщиной 10 - 4 - 10 - s см, на котором пиролитическим разложением дихло-рида олова SnClg нанесен пропускающий свет тонкий слой диоксида олова SnCb. Одним из электродов системы служит металлический тантал, другим - слой диоксида олова. [17]
Оставшийся после экстракции раствор упаривают на водяной бане почти досуха, растворяют в горячем диэтиловом спирте и охлаждают. При охлаждении количественно выделяются дихло-риды аминов. Их сушат, взвешивают и рассчитывают процентное содержание аминов в полиамиде. [18]
 |
Винильные производные свинца. [19] |
Реакцией между тетравинилсвинцом и трихлоруксусной кислотой может быть выделен тривинилтрихлорацетилплюмбан. С хлором Тетравинилсвинец реагирует с образованием дихло-рида дивинилсвинца. [20]
При хлорировании платины увеличение степени ее окисления не зависит от размера кристаллитов. При 450 С, в основном, образуется дихло-рид платины. В результате дисперсность возрастает в 3 - 4 раза. При последующей прокалке в воздухе при 580 С платина подвергается дальнейшему окислению до Pt, причем, несмотря на высокую температуру, дисперсность несколько увеличивается. [21]
Была исследована возможность использования эфиров таких суль-фохлоридов в качестве пластификаторов. Оказалось, что для этой цели сульфохлорирование следует вести таким образом, чтобы в образующейся смеси моно - и дисульфохлоридов содержалось возможно меньше дихло-ридов и хлора. [22]
Показано [53], что титан в растворимом комплексе находится в трехвалентном состоянии. Восстановление Ti4, очевидно, заключает три стадии: 1) образование комплекса между сэндвичевым дихлоридом и ал килалюминиевым соединением; 2) алкилирование сэндвичевого дихло-рида и 3) гемолитический распад связи алкил - титан. [23]
Хлорид меди, нанесенный на пемзу, оказывается также активным катализатором при хлорировании технической смеси изобути-лена и н-бутана [132], содержащей 4 - 6 % С3Н6, 13 - 18 % изобута-на и 73 - 80 % н-бутана. При 350 С и двукратном молярном избытке углеводородов в реакционной смеси выход жидких продуктов реакции составляет 52 8 % по отношению к исходному хлору. В результате реакции образуется 30 - 40 % монохлоридов, 11 - 14 % дихло-ридов и 48 - 50 % полихлорзамещенных. Однако активность катализатора очень быстро падает ( за 10 час. Более устойчивой чем хлорид меди активностью обладают хлориды молибдена и вольфрама. Полученный с этим катализатором продукт хлорирования по составу практически не отличается от приведенного выше. [24]
Образовавшийся после присоединения протона катион а может непосредственно присоединить анион хлора с образованием обычного продукта 1 2-присоединения. Однако он может также реагировать в виде катиона б, который возникает из а при перетягивании катионным центром подвижных я-электронов двойной связи. Естественно, что оба продукта, имея еще одну двойную связь, могут присоединить еще по одной молекуле хлороводорода и дать предельные дихло-риды. [25]
При гидролизе цианокобаламина, помимо идентифицированных выше продуктов расщепления, остается красный аморфный остаток, который содержит весь координационно связанный кобальт. В результате кислого гидролиза витамина горячим раствором соляной кислоты средней крепости образуется красный аморфный остаток, представляющий собой смесь кислот, содержащих от одной до семи карбоксильных групп [27], которые могут быть разделены электрофорезом. Гептакарбоновая кислота, не содержащая 5 6-диметилбензимидазолнуклеотида и D - 1-аминопропанола - 2, представляет собой кобириновую кислоту ( III, схема 130), выделенную в виде дихло-рида. [26]
Дихло-рид и его гидраты-протравы при крашении тканей, микродобавки в корм скоту, компоненты р-ров для нанесения покрытий Со на металлы, дихлорид используют также для получения катализаторов, в индикаторах влажности. [27]
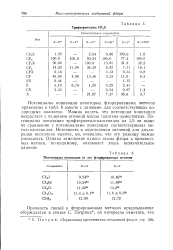 |
Потенциалы ионизации ( в эв фторированных метанов. [28] |
Потенциалы ионизации некоторых фторированных метанов приведены в табл. 6 вместе с данными для соответствующих водородных аналогов. Можно видеть, что потенциал ионизации возрастает с падением атомной массы галогена-заместителя. Неточность в определении значений для дихло-ридов несколько высока, но, очевидно, что эту разницу можно уменьшить. Однако замещение одного атома фтора в производных метана, по-видимому, оказывает лишь незначительное влияние. [29]
Железные опплкп или стружки помещают прямо в фарфоровую трубку-реактор, соединенную с источником сухого хлористого водорода и с приемником, который надевают на конец реактора, обернутый асбестом. Приемником может служить кварцевая колба или шамотовый стакан. Приошшк должен непосредственно соприкасаться с раскаленной частью трубчатой электропечи, в которой находится реактор. Вытеснив из трубки воздух хлористым водородом, ее нагревают в токе хлористого водорода до 900 С или несколько выше. Образующийся дихло-рид железа собирается в ирисмвике. Чтобы продукт не конденсировался в трубке, отводящий конец ее должен быть раскален, а следовательно, должен быть коротким. [30]
Страницы: 1 2